Aromatik uglevodorod

Aromatik uglevodorod — molekulasida benzol yadrosi boʻlgan uglevodorod. Aromatik uglevodorodning asosiy vakillari benzol (C6H6) va uning hosilalaridir (masalan, toluol: C6H5-CH3, stirol: C6H5-CH=CH2 va boshqalar). Arenlarning dastlabki topilgan aʼzolari oʻziga xos yoqimli hidga ega boʻlganligi sababli ular aromatik uglevodorodlar deb ataladi. Benzol yadrolari kondensirlangan aromatik uglevodorodlarga naftalin, antrasen, fenantren va boshqalar kiradi. Baʼzi kondensirlangan aromatik uglevodorodlarning molekulasi juda koʻp benzol yadrosidan tashkil topgan boʻladi (masalan, koronenda 6 ta). Aromatik uglevodorodlarning asosiy manbai toshkoʻmirni kokslash natijasida olinadigan mahsulotlardir.[1]
C6H5Cl+NaCH3=C6H5CH3+NaCl
Benzol molekulasining tuzilishi
[tahrir | manbasini tahrirlash]
Umumiy formulasi C6H6 boʻlganligi sababli uni toʻyinmagan birikmalar qatoriga kiritish mumkin. Lekin benzol bromli suv va kaliy permanganat eritmasi bilan reaksiyaga kirishmaydi, yaʼni toʻyinmagan birikmalarga xos reaksiyalarga kirishmaydi. Benzol bugʻi bilan vodorod gazi aralashmasi katalizatorga ega (Pt) qizdirilgan nay orqali oʻtkazilsa, benzolning har bir molekulasiga uch molekula vodorod birikib, tsiklogeksan hosil boʻladi:
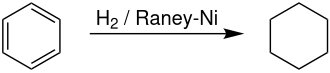
Bu xossa benzolning halqali tuzilishiga ega ekanligini isbotlaydi. „Molekula tarkibidagi uglerodning olti atomi tsikl tuzib yopiladi va ular oʻzaro qoʻshbogʻ va oddiy bogʻ orqali navbat bilan joylashadi“, deb benzolning tuzilish formulasini birinchi marta nemis olimi A.Kekule taklif qildi.
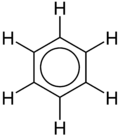
XX asrning boshlaridagina har xil fizik usullardan foydalanish natijasida benzol molekulasining tuzilishini tushuntirishga mavaffaq boʻlindi. Barcha uglerod atomlari oʻxshash, elekrton zichligi bir xil ajratilgan, uglerod atomlarining masofasi oʻzaro teng (0,140 nm). Benzol molekulasi teng tomonli olti burchakli shaklda boʻladi. Benzoldagi har bir uglerod atomida bitta s- va ikkita p-elektron bulutlari sp2-gibridlangan holatda boʻladi, ammo bitta p-elektron buluti gibridlanmagan. Uchala gibridlangan orbitallar bitta tekislikda joylashib, iiki tomondagi uglerod atomlari va bir vodorod atomi orbitallari bilan qoplanadi. Natijada uchta σ-bogʻ hosil boʻladi. Har bir uglerodning gibridlanmagan p-orbitali shu tekislikka perpendikulyar joylashib, bu bulutlar ham bir-biri bilan qoplanadi. Bu qoplanishlar gibridlangan orbitallar yotgan tekislikning ikki tomonida (osti va ustida) amalga oshadi. Natijada benzolning oltita uglerod atomining 2p-orbitallari qoplanishidan π-bogʻ hosil boʻladihamda umumiy π-elektron yopiq tizim vujudga keladi.
| Bogʻlanish turi | Gibridlanish turi | Bogʻlanish burchagi | Bogʻlanish uzunligi, nm | Bogʻlanish energiyasi, kJ/mol |
|---|---|---|---|---|
| Oddiy (— C — C —) | sp3 | 109°28ʼ | 0,154 | 350 |
| Qoʻshbogʻ (— C = C —) | sp2 | 120° | 0,134 | 612 |
| Uch bogʻ (— C ≡ C —) | sp | 180° | 0,120 | 830 |
| Aromatik bogʻlanish | sp2 | 120° | 0,140 | 490 |
Arenlarning gomologlari, izomerlari va nomlanishi
[tahrir | manbasini tahrirlash]Aromatik uglevodorodlar sistematik nomenklatura boʻyicha arenlar deb ataladi. Benzol molekulasining vodorod atomlari radikallarga almashinganda benzolning gomologlar hosil boʻladi.
| Benzol | Metilbenzol | Etilbenzol | Propilbenzol |
|---|---|---|---|
| C6H5 — H | C6H5 — CH3 | C6H5 — C2H5 | C6H5 — C3H7 |
Benzolning gomologlarini nomlash uchun shakllangan trivial nomlashlar ham ishlatiladi: metilbenzol — toluol, dimetilbenzol — ksilol, izopropilbenzol — kumol, vinilbenzol — stirol deb ataladi. Molekulasida bir necha radikallar boʻlgan birikmalarni nomlash uchun benzol halqasidagi uglerod atomlari raqamlanib, birikma nomlanganda oʻrinbosar (radikal)ning oʻrni sonlar orqali koʻrsatiladi. Agar benzol molekulasining ikkita vodorod atom radikallarga almashingan boʻlsa, u holda benzolning orto-, meta-, para- hosilalari paydo boʻladi. Ular qisqacha birinchi harfi bilan belgilanadi: orto — o, meta — m, para — p. Shuningdek, harflar oʻrniga sonlar orqali belgilash ham qabul qilingan.
-
o-ksilol
(1,2-dimetilbenzol) -
m-ksilol
(1,3-dimetilbenzol) -
p-ksilol
(1,4-dimetilbenzol)
Arenlarning olinishi
[tahrir | manbasini tahrirlash]Arenlar asosan toshkoʻmir smolasi va neftni fraktsiyalash yoʻli orqali haydab olinadi. Shu bilan birga toshkoʻmirni kokslaganda va neftni haydashda hosil boʻladigan gazlarni sintezlash orqali ham olinadi.
Alkanlarni katalizator ishtirokida aromatlab degidrogenlashda (riforning) benzol va uning hosilalari hosil boʻladi.
Arenlarni tsiklogeksan va uning gomologlarini degidrogenlab olish mumkin. N. D. Zelinskiy neftning tarkibidagi tsiklogeksanni Pt, Pd katalizatorlari ishtirokida 300 °C haroratda degidrogenlab benzol oldi. Ushbu keltirilgan tsikogeksan hosilalari degidrogenlanganda, benzolning hosilalari hosil boʻladi:
Faollashtirilgan koʻmir toʻldirilib, qizdrilgan nay orqali atsetilen oʻtkazish bilan benzol oʻzlashtirish mumkin:

Fizik xossalari
[tahrir | manbasini tahrirlash]Aromatik uglevodorodlar oʻziga xos hidli, suvda erimaydigan, suvdan yengil suyuq moddalardir. Aromatik uglevodorodlar bir qator organik erituvchilarda yaxshi eriydi va koʻpchilik organik moddalarni eritadi. Benzol gomologlarining nisbiy molekulyar massalarining suyuqlanishi bilan bogʻliq holda erish va qaynash haroratlari qonuniy ravishda oshadi. Benzol zaharli modda. Benzol bugʻi bilan doimiy nafas olinganda anemiya, leykemiya kabi kasalliklarga duchor boʻladi. Toluol va boshqa gomologlarining zarari benzolga qaragnada kamroq.
Kimyoviy xossalari
[tahrir | manbasini tahrirlash]Arenlar oʻrin olish, birikish va oksidlanish reaksiyalariga kirishadi.
Oʻrin olish reaksiyalari
[tahrir | manbasini tahrirlash]Galogenlar bilan oʻrin olish reaksiyalari temir (III) tuzlari ishtirokida boradi:
Nitrolash raeksiyasi. Nitrlovchi aralashmaning ishtirokida qizdirilganda benzoldan nitrobenzol hosil boʻladi:
Benzolning gomologlari oʻrin olish reaksiyalariga benzolga qaraganda oson kirishadi. Masalan: metilbenzol (toluol) oʻrin olish reaksiyasiga benzoldan koʻra oson kirishadi va 2-,4-,6-holatdagi vodorod atomlari oson almashinadi. Toluolning nitrat kislotasi bilan reaksiyaga kirishishi natijasida 2,4,6-trinitrotoluol hosil boʻladi.
2-,4-,6-trinitrotoluol trotil, tol, TNT deb ataladi, portlovchi modda sifatida ishlatiladi.[2]
Birikish reaksiyalari
[tahrir | manbasini tahrirlash]Aromaik uglevodorodlarning birinchi vakili benzol birikish reaksiyalariga qiyin kirishadi[3]. Faqat qattiq qizdirilganda yoki ultrabinafsha nurlar bilan taʼsir etganda va katalizator ishtirokidagina benzol toʻyinmagan xossani namoyon qilib, vodorod va galogenlarni biriktirib oladi.
Gidrogenlanishi — Nikel, platina, palladiy singari katalizatorlar ishtirokida qizdirilganda va yuqori bosim taʼsirida benzol vodorodni biriktirib olib tsiklogeksanga aylanadi[4][5].
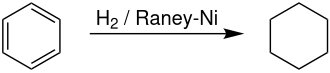
Galogenlarni biriktirib olishi. Ultrabinafsha nurlarining taʼsirida benzol xlorning olti atomini biriktirib olib, natijada geksaxlortsiklogeksan (geksaxloran) hosil boʻladi:

Manbalar
[tahrir | manbasini tahrirlash]- ↑ Artikel Atom by Atom, Bond by Bond, a Chemical Reaction Caught in the Act, Pressemitteilung des Lawrence Berkeley National Laboratory, abgerufen am 13. Juni 2013.
- ↑ „СПОСОБ В.Ф.МОЖАРОВСКОГО КОМПЛЕКСНОГО ЭТИОЛОГИЧЕСКОГО ЛЕЧЕНИЯ ПСОРИАЗА ПРОТИВОВИРУСНЫМ И ПРОТИВОМИКРОБНЫМИ ПРЕПАРАТАМИ "ЛИКВАЦИД", "ТРИНОЛ", "ТРИСОЛИД" И "ТРОТИПИД" - Патент РФ 2102072“. ru-patent.info. 2019-yil 17-dekabrda asl nusxadan arxivlangan. Qaraldi: 2019-yil 23-yanvar. (Wayback Machine saytida 2019-12-17 sanasida arxivlangan)
- ↑ Stranks, D. R.; M. L. Heffernan; K. C. Lee Dow; P. T. McTigue; G. R. A. Withers. Chemistry: A structural view. Carlton, Victoria: Melbourne University Press, 1970 — 347-bet. ISBN 978-0-522-83988-3.
- ↑ Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng „On Present Methods of Hydrogenation of Aromatic Compounds, 1945 to Present Day“ Lunds Tekniska Högskola 2008
- ↑ Ceresana „Benzene - Study: Market, Analysis, Trends 2021 - Ceresana“. www.ceresana.com. 21-dekabr 2017-yilda asl nusxadan arxivlangan. Qaraldi: 4-may 2018-yil.
Adabiyotlar
[tahrir | manbasini tahrirlash]- OʻzME. Birinchi jild. Toshkent, 2000-yil
| Ushbu maqolada Oʻzbekiston milliy ensiklopediyasi (2000-2005) maʼlumotlaridan foydalanilgan. |
Bu andozani aniqrogʻiga almashtirish kerak. |








![{\displaystyle {\mathsf {2C_{6}H_{5}CH_{3}{\xrightarrow[{}]{HNO_{3},H_{2}SO_{4}}}C_{6}H_{4}CH_{3}(NO_{2})+C_{6}H_{3}CH_{3}(NO_{2})_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fb1a18d13315cf590315edcfbe1eeec96d4c0c4b)

