Allil guruhi
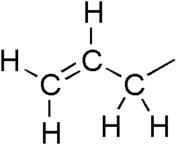
Allil guruhi H2C=CH−CH2R tuzilish formulasiga ega boʻlgan oʻrinbosar, bu yerda R molekulaning qolgan qismidir. U vinil guruhiga (−CH=CH 2) biriktirilgan metilen koʻprigidan (−CH 2 -) iborat.[1][2] Bu nom lotincha sarimsoq Allium sativum soʻzidan olingan. 1844-yilda Teodor Vertgeym sarimsoq yogʻidan allil hosilasini ajratib oldi va uni „Shvefelallyl“ deb nomladi.[3][4] Allil atamasi H 2 C=CH−CH 2 bilan bogʻliq boʻlgan koʻplab birikmalar uchun qoʻllanadi, ulardan baʼzilari amaliy yoki kundalik ahamiyatga ega, masalan, allil xlorid. Allylation – substratga allil guruhini qoʻshadigan har qanday kimyoviy reaksiya.[1]
Nomenklatura
[tahrir | manbasini tahrirlash]
Toʻyinmagan uglerod atomiga qoʻshni boʻlgan joy, allilik pozitsiya yoki allilik joy deb ataladi. Ushbu saytga biriktirilgan guruh baʼzan ittifoqchi deb taʼriflanadi. Shunday qilib, CH 2=CHCH 2 OH „allik gidroksil guruhiga ega“. Allilik C-H aloqalari oddiy sp <sup id="mwMQ">3</sup> uglerod markazlaridagi C-H aloqalariga qaraganda taxminan 15% zaif va shuning uchun koʻproq reaktivdir. Bu kuchaygan reaktivlik koʻplab amaliy oqibatlarga olib keladi. Propenni amoksidlash orqali akrilonitrilni sanoat ishlab chiqarish allil C-H markazlarining oson oksidlanishidan foydalanadi:: 2CH 3 −CH=CH 2 + 2 NH 3 + 3 O 2 → 2CH 2 =CH−C≡N + 6 H 2 O
Toʻyinmagan yogʻlar allilik C-H markazlariga hujumni oʻz ichiga olgan ransidifikatsiya orqali buziladi.
Benzil va alilik tuzilish, bogʻlanish kuchi va reaktivlik jihatidan oʻzaro bogʻliq. Allilik birikmalar bilan sodir boʻladigan boshqa reaksiyalar allilik oksidlanishlar, ene reaksiyalari va Tsuji-Trost reaksiyalaridir. Benzil guruhlari allil guruhlari bilan bogʻliq; ikkalasi ham yaxshilangan reaktivlikni koʻrsatadi.
Pentadienil
[tahrir | manbasini tahrirlash]Ikkita vinil guruhiga bogʻlangan CH2 guruhi ikki tomonlama allilik deb ataladi. Ikki martali allilik markazdagi C-H bogʻlarining ajralish energiyasi allilik boʻlgan C-H bogʻlanishning ajralish energiyasidan taxminan 10% kamroq. Zaiflashgan C-H aloqalari hosil boʻlgan pentadienil radikallarining yuqori barqarorligini aks ettiradi. C=C−CH2−C=C bogʻlanishlarini oʻz ichiga olgan birikmalar, masalan, linoleik kislota hosilalari, polimerlanishga olib kelishi yoki yarim qattiq moddalar hosil qilishi mumkin boʻlgan avtooksidlanishga moyil boʻladi. Ushbu reaktivlik sxemasi yogʻli boʻyoqlar va laklarning tarkibiy qismlari boʻlgan " quritish moylari " ning plyonka hosil qilish harakati uchun asosdir.
Gomoalilik
[tahrir | manbasini tahrirlash]Gomoalilik atamasi uglerod skeletidagi allik pozitsiyasi yonidagi pozitsiyani anglatadi. But-3-vinilxlorid CH2=CHCH2CH 2 Cl da xlorid gomoalilikdir, chunki u gomoalilik joy bilan bogʻlangan.

Bogʻlanish
[tahrir | manbasini tahrirlash]Allil guruhi organik kimyoda keng tarqalgan.[1] Allilik radikallar, anionlar va kationlar koʻpincha reaksiyalarda oraliq moddalar sifatida muhokama qilinadi. Ularning barchasida uchta qoʻshni sp²-gibridlangan uglerod markazlari mavjud va ularning barchasi rezonansdan barqarorlikni oladi.[5] Har bir tur ikkala 1,3 pozitsiyada taqsimlangan zaryad yoki juftlashtirilmagan elektron bilan ikkita rezonans tuzilmasi bilan taqdim etilishi mumkin.
MO nazariyasi nuqtai nazaridan, MO diagrammasi uchta molekulyar orbitalga ega: birinchisi bogʻlanish, ikkinchisi bogʻlanmaydigan va yuqori energiyali orbital antibogʻlanishdir.[2]

Allil radikalidagi p orbitallar uchun MO diagrammasi. r 2 bilan belgilangan oʻrta MO birma-bir allil radikalida joylashgan. Allil kationida r 2 band boʻlmagan, allil anionida esa ikki marta ishgʻol qilingan. Ushbu rasmda vodorod atomlari yoʻq.
Reaksiyalar
[tahrir | manbasini tahrirlash]Karbonilallanish
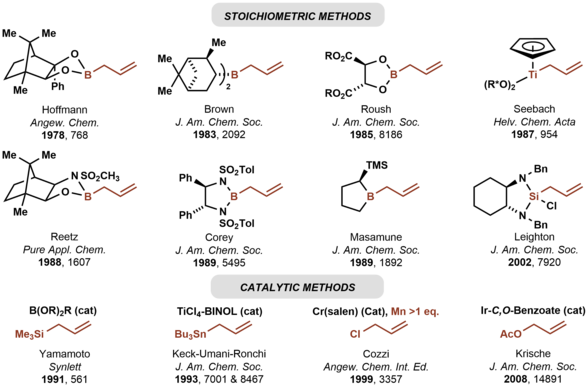
[tahrir | manbasini tahrirlash]Karbonil allilatsiyasi allil guruhini kiritish uchun ishlatiladigan eng keng tarqalgan usullardan biridir. Karbonil allyasiya quyidagi ikki bosqichli jarayonda tasvirlanganidek, aldegid yoki ketonga allil anionining gomoalilik spirtini hosil qilish uchun qoʻshilishini bildiradi. Birinchi karbonil allyasiya haqida 1876-yilda Aleksandr Zaitsev xabar bergan va allilsink reagentidan foydalangan.[6]
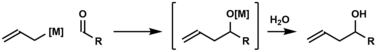
Enantioselektiv karbonil allyasiya uchun birinchi chiral allilmetal reagentlari Hoffman tomonidan ishlab chiqilgan.[7] Keyinchalik koʻplab chiral allilmetal reagentlar ishlab chiqildi.[8][9][10][11][12][13] Ular orasida „jigarrang reagent“, allildiizopinokamfeylboran keng qoʻllangan.[9] Kek allyatsiyasida koʻrsatilganidek, karbonil birikmalariga axiral[14] reagentlarning katalitik enantioselektiv qoʻshilishi ham mumkin.[15] Yuqorida aytib oʻtilgan assimetrik karbonil allilatsiyalari oldindan tuzilgan allilmetal reagentlarga tayansa, Krische allyatsiyasi enantioselektiv karbonil allilatsiyasi uchun moʻl-koʻl kimyoviy xom ashyo boʻlgan allil asetatdan foydalanadi.[16] Asimmetrik karbonil alyansi uchun tanlangan usullar quyida umumlashtiriladi.
Karbonil allyasiya koʻpincha poliketidli tabiiy mahsulotlar va boshqa kislorodli molekulalarni qoʻshni stereosentrlar majmuasi bilan qurish uchun ishlatiladi. Misol uchun, Stiven V. Ley va uning hamkasblari FK506 va rapamitsinga oʻxshash va FKBP12 ning kuchli bogʻlovchisi boʻlgan makrolid antaskomitsin B ni yaratish uchun treozadan olingan aldegidning allilstannanatsiyasidan foydalanganlar.[17] Krische allyatsiyasi 14 ta stereogen markazga ega boʻlgan makrodiolid ionofor boʻlgan poliketidli tabiiy mahsulotni (+)-SCH 351448 tayyorlash uchun ishlatilgan.[18]

Konjugat qoʻshilishi
[tahrir | manbasini tahrirlash]Konjugat allyasiya enonning beta-pozitsiyasiga allil guruhining qoʻshilishini anglatadi. Xosomi-Sakurai reaksiyasi konjugat allyasiya uchun eng koʻp qoʻllanadigan usuldir.[19]
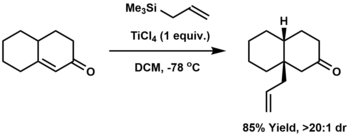
Allil birikmalari
[tahrir | manbasini tahrirlash]Turgʻun birikmalar berish uchun koʻplab oʻrinbosarlarni allil guruhiga biriktirish mumkin. Tijorat jihatdan muhim allil birikmalariga quyidagilar kiradi:
- Allil spirti (H 2 C = CH – CH 2 OH)
- Allilxlorid (H 2 C=CH−CH 2 Cl)
- Krotil spirti (CH 3 CH = CH – CH 2 OH)
- Dimetilalil pirofosfat, terpenlarning biosintezida markaziy, koʻplab tabiiy mahsulotlar, shu jumladan tabiiy kauchuk uchun kashshof.
- Oʻtish-metall allil komplekslari, masalan, allilpalladiy xlorid dimer
Yana qarang
[tahrir | manbasini tahrirlash]- Allilik shtamm
- Kerolni qayta tashkil etish
- Allilik palladiy kompleksi
- Tsuji-Tros reaksiyasi
- Propargil/Homopropargilik
- Benzil
- Vinil
- Asetilenik
- Nalokson
- Allilik qayta tartibga solish
- Diallylisergamid
- Terpen
Manbalar
[tahrir | manbasini tahrirlash]- ↑ 1,0 1,1 1,2 Jerry March, „Advanced Organic Chemistry“ 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 0-471-60180-2. Manba xatosi: Invalid
<ref>tag; name "March" defined multiple times with different content - ↑ 2,0 2,1 Organic Chemistry 4th Ed. Morisson & Boyd 1988.
- ↑ Theodor Wertheim (1844). „Untersuchung des Knoblauchöls“. Annalen der Chemie und Pharmacie. 51-jild, № 3. 289–315-bet. doi:10.1002/jlac.18440510302.
- ↑ Eric Block. Garlic and Other Alliums: The Lore and the Science. Royal Society of Chemistry, 2010. ISBN 978-0-85404-190-9.
- ↑ Organic Chemistry John McMurry 2nd ed. 1988
- ↑ Michael; Saytzeff, Alexander (1877). „Synthese des Allyldimethylcarbinols“. Justus Liebigs Annalen der Chemie (inglizcha). 185-jild, № 2–3. 151–169-bet. doi:10.1002/jlac.18771850204. ISSN 1099-0690. 2022-03-06da asl nusxadan arxivlandi. Qaraldi: 2022-06-08.
- ↑ Herold, Thomas; Hoffmann, Reinhard W. (October 1978). „Enantioselective Synthesis of Homoallyl Alcoholsvia Chiral Allylboronic Esters“. Angewandte Chemie International Edition in English (inglizcha). 17-jild, № 10. 768–769-bet. doi:10.1002/anie.197807682. ISSN 0570-0833.
- ↑ Hayashi, Tamio; Konishi, Mitsuo; Kumada, Makoto (September 1982). „Optically active allylsilanes. 2. High stereoselectivity in asymmetric reaction with aldehydes producing homoallylic alcohols“. Journal of the American Chemical Society (inglizcha). 104-jild, № 18. 4963–4965-bet. doi:10.1021/ja00382a046. ISSN 0002-7863.
- ↑ 9,0 9,1 Brown, Herbert C.; Jadhav, Prabhakar K. (April 1983). „Asymmetric carbon-carbon bond formation via.beta.-allyldiisopinocampheylborane. Simple synthesis of secondary homoallylic alcohols with excellent enantiomeric purities“. Journal of the American Chemical Society (inglizcha). 105-jild, № 7. 2092–2093-bet. doi:10.1021/ja00345a085. ISSN 0002-7863.
- ↑ Roush, William R.; Walts, Alan E.; Hoong, Lee K. (December 1985). „Diastereo- and enantioselective aldehyde addition reactions of 2-allyl-1,3,2-dioxaborolane-4,5-dicarboxylic esters, a useful class of tartrate ester modified allylboronates“. Journal of the American Chemical Society (inglizcha). 107-jild, № 26. 8186–8190-bet. doi:10.1021/ja00312a062. ISSN 0002-7863.
- ↑ Kinnaird, James W. A.; Ng, Pui Yee; Kubota, Katsumi; Wang, Xiaolun; Leighton, James L. (2002-07-01). „Strained Silacycles in Organic Synthesis: A New Reagent for the Enantioselective Allylation of Aldehydes“. Journal of the American Chemical Society (inglizcha). 124-jild, № 27. 7920–7921-bet. doi:10.1021/ja0264908. ISSN 0002-7863. PMID 12095334.
- ↑ Short, Robert P.; Masamune, Satoru (March 1989). „Asymmetric allylboration with B-allyl-2-(trimethylsilyl)borolane“. Journal of the American Chemical Society (inglizcha). 111-jild, № 5. 1892–1894-bet. doi:10.1021/ja00187a061. ISSN 0002-7863.
- ↑ Corey, E. J.; Yu, Chan Mo; Kim, Sung Soo (July 1989). „A practical and efficient method for enantioselective allylation of aldehydes“. Journal of the American Chemical Society (inglizcha). 111-jild, № 14. 5495–5496-bet. doi:10.1021/ja00196a082. ISSN 0002-7863.
- ↑ Keck, Gary E.; Tarbet, Kenneth H.; Geraci, Leo S. (September 1993). „Catalytic asymmetric allylation of aldehydes“. Journal of the American Chemical Society (inglizcha). 115-jild, № 18. 8467–8468-bet. doi:10.1021/ja00071a074. ISSN 0002-7863.
- ↑ Denmark, Scott E.; Fu, Jiping (2003-08-01). „Catalytic Enantioselective Addition of Allylic Organometallic Reagents to Aldehydes and Ketones“. Chemical Reviews (inglizcha). 103-jild, № 8. 2763–2794-bet. doi:10.1021/cr020050h. ISSN 0009-2665. PMID 12914480.
- ↑ Kim, In Su; Ngai, Ming-Yu; Krische, Michael J. (2008-11-05). „Enantioselective Iridium-Catalyzed Carbonyl Allylation from the Alcohol or Aldehyde Oxidation Level via Transfer Hydrogenative Coupling of Allyl Acetate: Departure from Chirally Modified Allyl Metal Reagents in Carbonyl Addition“. Journal of the American Chemical Society (inglizcha). 130-jild, № 44. 14891–14899-bet. doi:10.1021/ja805722e. ISSN 0002-7863. PMC 2890235. PMID 18841896.
- ↑ Brittain, Dominic E. A.; Griffiths-Jones, Charlotte M.; Linder, Michael R.; Smith, Martin D.; McCusker, Catherine; Barlow, Jaqueline S.; Akiyama, Ryo; Yasuda, Kosuke; Ley, Steven V. (2005). „Total Synthesis of Antascomicin B“. Angewandte Chemie International Edition. 44-jild, № 18. 2732–2737-bet. doi:10.1002/anie.200500174. ISSN 1521-3773. PMID 15806607.
- ↑ Wang, Gang; Krische, Michael J. (2016-07-06). „Total Synthesis of (+)-SCH 351448: Efficiency via Chemoselectivity and Redox-Economy Powered by Metal Catalysis“. Journal of the American Chemical Society. 138-jild, № 26. 8088–8091-bet. doi:10.1021/jacs.6b04917. ISSN 0002-7863. PMC 4935581. PMID 27337561.
- ↑ Hosomi, Akira; Sakurai, Hideki (March 1977). „Chemistry of organosilicon compounds. 99. Conjugate addition of allylsilanes to.alpha.,.beta.-enones. A New method of stereoselective introduction of the angular allyl group in fused cyclic.alpha.,.beta.-enones“. Journal of the American Chemical Society (inglizcha). 99-jild, № 5. 1673–1675-bet. doi:10.1021/ja00447a080. ISSN 0002-7863.


