Henry reaksiyasi
Henry reaksiyasi — bu organik kimyoda uglerod-uglerod bogʻlanishining klassik reaksiyasi. 1895-yilda belgiyalik kimyogari Lui Henry (1834-1913) tomonidan kashf etilgan boʻlib, u nitroalkan va aldegid yoki ketonning asos ishtirokida birikmasi boʻlib, b-nitro spirtlarini hosil qiladi.[1][2][3] Ushbu turdagi reaksiya nitroaldol reaksiyasi (nitroalkan, aldegid va spirt) deb ham ataladi. Bu deyarli 23 yil oldin kashf etilgan aldol reaksiyasiga oʻxshaydi, bu ikki karbonil birikmasini birlashtirib, „aldollar“ (aldegid va spirt) deb nomlanuvchi b-gidroksi karbonil birikmalarini hosil qiladi.[2][4] Henry reaksiyasi organik kimyo sohasidagi foydali texnika boʻlib, u tegishli mahsulotlarning sintetik foydaliligi tufayli boshqa foydali sintetik oraliq mahsulotlarga osongina aylantirilishi mumkin. Ushbu konversiyalar nitroalkenlarni olish uchun keyingi suvsizlanishni, a-nitro ketonlarni olish uchun ikkilamchi spirtning oksidlanishini yoki b-amino spirtlarini olish uchun nitro guruhini kamaytirishni oʻz ichiga oladi.

Ushbu foydalanishning koʻpchiligi turli farmatsevtika preparatlari sintezida, jumladan -bloker (S)-propranolol,[5][6] OIV proteaza inhibitori Amprenavir (Vertex 478) va antratsiklin sinfining uglevod boʻlinmasini qurishda misol qilib keltirilgan. antibiotiklar, L-Acosamine.[6] L-Acosamine sintezining sintetik sxemasini ushbu maqolaning Misollar boʻlimida topish mumkin.
Mexanizm
[tahrir | manbasini tahrirlash]Henry reaksiyasi nitroalkanning -uglerod holatida nitronat hosil boʻlishida deprotonatsiyasi bilan boshlanadi. Aksariyat nitroalkanlarning pKa qiymati taxminan 17 ni tashkil qiladi[7][8] Garchi bu struktura deprotonlangan uglerodda ham, nitroguruhning oksi-anionlarida ham nukleofil boʻlsa ham,[9] kuzatilgan natija karbonil birikmasiga uglerodning hujum qilishidir. Olingan -nitroalkoksid dastlab nitroalkil tuzilishini deprotonatsiya qilgan asosning konjugat kislotasi bilan protonlanadi va mahsulot sifatida tegishli -nitro spirtini beradi.

Shuni taʼkidlash kerakki, Henry reaksiyasining barcha bosqichlari teskari. Bu mahsulot hosil boʻlish reaksiyasida qatʼiy qadam yoʻqligi bilan bogʻliq. Aynan shu sababli, tadqiqot yakuniy reaksiyani qoʻzgʻatish uchun modifikatsiyalarga qaratilgan.[2][3] Bu haqda batafsil maʼlumotni ushbu maqolaning oʻzgartirish boʻlimida topishingiz mumkin.
Stereokimyoviy kurs
[tahrir | manbasini tahrirlash]Quyidagi rasmda Henry reaksiyasiga hech qanday oʻzgartirish kiritmasdan stereoseleksiya uchun umumiy qabul qilingan modellardan biri tasvirlangan. Ushbu modelda stereoselektivlik modeldagi R guruhlari hajmi (masalan, uglerod zanjiri), shuningdek, nitro guruhi va karbonil kislorodni bir-biriga qarshi (qarama-qarshi tomonlarda) yoʻnaltirish orqali dipolni minimallashtiradigan oʻtish holati bilan boshqariladi. molekulasi). R guruhlari Henry reaksiyasining oʻtish holatida rol oʻynaydi: substratlarning har birida R guruhlari qanchalik katta boʻlsa, ular bir-biridan uzoqroq yoʻnaltirishga moyil boʻladi (odatda sterik effektlar deb ataladi).[3][10]
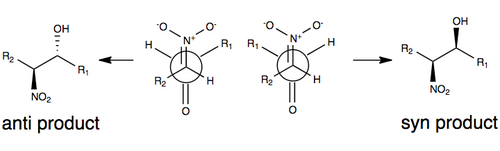
Reaksiyaning qaytarilishi va nitro-almashtirilgan uglerod atomining oson epimerizatsiyasi tendentsiyasi (bir qator omillar orasida) tufayli Henry reaksiyasi odatda enantiomerlar yoki diastereomerlar aralashmasini hosil qiladi. Aynan shuning uchun stereoselektivlik uchun tushuntirishlar reaksiyaning baʼzi oʻzgarishlarisiz kamligicha qolmoqda.[3] Soʻnggi yillarda tadqiqot eʼtibori ushbu sintetik muammoni engish uchun Henry reaksiyasini oʻzgartirishga qaratildi.
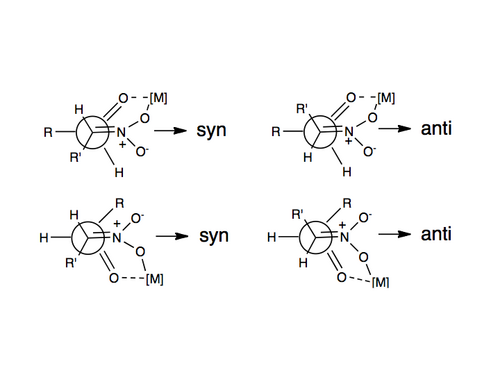
Enantioselektiv nitroaldol reaksiyasining birinchi misoli 1992-yilda Shibasaki katalizatorlari yordamida xabar qilingan.[11] Henry reaksiyasida enantio- yoki diasteroselektivlikni qoʻzgʻatishning eng koʻp qoʻllanadigan usullaridan biri bu nitro guruhi va karbonil kislorodni chiral organik molekula bilan bogʻlangan metallga muvofiqlashtiradigan chiral metal katalizatorlaridan foydalanishdir. Ishlatilgan baʼzi metallarga rux, kobalt, mis, magniy va xrom kiradi.[12] Ushbu muvofiqlashtirishning tasviri yuqorida tasvirlangan.
Henry reaksiyasining sintetik jihatdan jozibador qiladigan koʻplab xususiyatlaridan biri shundaki, u reaksiyani boshlash uchun faqat katalitik miqdordagi asosdan foydalanadi. Bundan tashqari, ishqoriy metallar gidroksidlari, alkoksidlar, karbonatlar va ftorid anion manbalari kabi ion asoslari kabi turli asoslardan foydalanish mumkin. TBAF) yoki noionik organik amin asoslari, shu jumladan TMG, DBU, DBN va PAP. Shuni taʼkidlash kerakki, ishlatiladigan asos va erituvchi reaksiyaning umumiy natijasiga katta taʼsir koʻrsatmaydi.[2]
Cheklovlar
[tahrir | manbasini tahrirlash]Henry reaksiyasining asosiy kamchiliklaridan biri bu yon reaksiyalarning potentsialidir. Reaksiyaning davom etishiga toʻsqinlik qiladigan reaksiyaning (yoki „retro-Henry“) oʻziga xos qaytaruvchanligidan tashqari, b-nitro spirti ham suvsizlanishga olib kelishi mumkin. Sterilizatsiyalangan substratlar uchun asos katalizlangan oʻz-oʻzidan kondensatsiya (Kanizzaro reaksiyasi) sodir boʻlishi ham mumkin. Kannizzaro reaksiyasining umumiy sxemasi quyida tasvirlangan.[2]

Oʻzgartirishlar
[tahrir | manbasini tahrirlash]Henryx reaksiyasiga bir qator oʻzgartirishlar kiritildi. Ulardan eng muhimlari kimyoviy va regioselektivlikni yaxshilash uchun yuqori bosimli va baʼzan erituvchisiz sharoitlarni qoʻllashni oʻz ichiga oladi[2] va enantio yoki diasteroselektivlikni qoʻzgʻatish uchun chiral metall katalizatorlari.[12] Aza-Henry reaksiyasi nitroaminlarni ishlab chiqarish uchun ham qoʻllanadi va vicinal diaminlar sintezi uchun ishonchli sintetik yoʻl boʻlishi mumkin.[13]
Ehtimol, Henry reaksiyasining eng sintetik foydali modifikatsiyalaridan biri organokatalizatordan foydalanishdir.[2][12][14] Katalitik sikl quyida koʻrsatilgan.

Roʻyxat, bu keng tushuntirish boʻlsa-da, uning qisqacha sharhi shuni koʻrsatadiki, bu organokatalizator ishtirokidagi deyarli barcha reaksiyalar uchun ishonchli mexanik tushuntirishdir. Ushbu turdagi reaksiyaning namunasi ushbu maqolaning Misollar boʻlimida tasvirlangan.
Yuqorida aytib oʻtilgan Henry reaksiyasiga qoʻshimcha ravishda boshqa koʻplab oʻzgarishlar mavjud. Bunga reaktiv boʻlmagan alkil nitro birikmalarini karbonil substratlar bilan tezroq reaksiyaga kirishadigan mos dianionlarga aylantirish, asos sifatida PAP yordamida reaksiyalarni tezlashtirish, aldegidlarning a, a-ikki marta protonlangan nitroalkanlar bilan reaktivligidan nitronat alkoksidlarini berish uchun foydalanish kiradi. asosan sin-nitro spirtlari bir marta protonlanadi va nihoyat, nitroguruhdagi bir oksigenatom silil bilan himoyalangan nitronat anionlari hosil boʻlib, aldegid bilan reaksiyaga kirishganda ftorid anion manbai ishtirokida anti-b-nitro spirtlarini beradi.[2][3]
Misollar
[tahrir | manbasini tahrirlash]Sanoatda qoʻllanishi — 1999-yilda Menzel va uning hamkasblari antratsiklin antibiotiklar sinfining uglevod boʻlinmasi boʻlgan L — akozaminni olishning sintetik yoʻlini ishlab chiqdilar:[6][15]

Sanoatda qoʻllanishi — Enantioselektiv aldol qoʻshilishi mahsulotini assimetrik sintezda benzaldegidning nitrometan va Lyuis kislotasi sifatida rux triflat, diizopropiletilamin (DIPEA) va N -metilefedrin (NME) kabi katalizator tizimi bilan reaksiyaga kirishishi orqali olish mumkin. xiral ligand.[16]
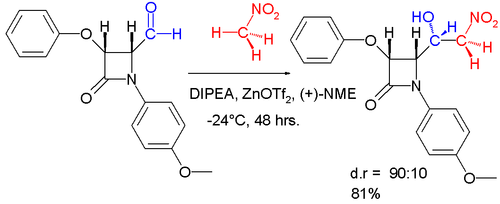
Ushbu reaksiyaning diastereoselektiv oʻzgarishi quyida tasvirlangan.[17]
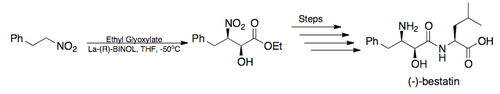
Jami sintez — 2005-yilda Barua va uning hamkasblari kuchli aminopeptidaza inhibitori (-)-bestatinning umumiy sintezini yakunladilar, buning natijasida umumiy rentabellik 26 % ni tashkil etdi va asosiy qadam sifatida Shibasaki assimetrik Henry reaksiyasini qoʻlladi. (quyida tasvirlangan)[6][18]
Organokataliz — 2006-yilda Xiemstra va uning hamkasblari aromatik aldegidlar va nitrometan oʻrtasidagi reaksiya uchun assimetrik katalizatorlar sifatida xinin hosilalaridan foydalanishni oʻrganishdi. Muayyan lotinlardan foydalanish orqali ular toʻgʻri katalizatordan foydalanish orqali toʻgʻridan-toʻgʻri enantioseleksiyani keltirib chiqarishga muvaffaq boʻlishdi.[19]

Biokataliz — 2006-yilda Purkarthofer va boshqalar. Hevea brasiliensis dan (S)-gidroksinitril liazasi (S)-b-nitro spirtlarining hosil boʻlishini katalizlashini aniqladi.[20] 2011-yilda Fuxshuku va Asano Arabidopsis thalianadan olingan (R)-selektiv gidroksinitril liazasi nitrometan va aromatik aldegidlardan (R)-b-nitro spirtlarining sintezini katalizlashi mumkinligini koʻrsatdi.[21]
Manbalar
[tahrir | manbasini tahrirlash]- ↑ Henry, Louis (1895). „Formation synthétique d'alcools nitrés“. Comptes rendus. 120-jild. 1265–1268-bet.
{{cite magazine}}: Unknown parameter|trans_title=ignored (|trans-title=suggested) (yordam) - ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 Kurti, L.. Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press, 2005 — 202–203-bet. ISBN 978-0-12-369483-6.
- ↑ 3,0 3,1 3,2 3,3 3,4 Noboro, Ono. The Nitro Group in Organic Synthesis. New York, NY: Wiley-VCH, 2001 — 30–69-bet. ISBN 978-0-471-31611-4.
- ↑ Wurtz, M.A. (1872). „Sur un aldéhyde-alcool“. Bull. Soc. Chim. Fr. 17-jild. 436–442-bet.
- ↑ Sasai, H., Suzuki, T., Itoh, N., Arai, S., Shibasaki, M. (1993). „Catalytic Asymmetric Nitroaldol Reaction: an efficient synthesis of (s) propranolol using the lanthenum binaphthol complex“. Tetrahedron Letters. 34-jild, № 52. 855–858-bet. doi:10.1016/0040-4039(93)89031-K.
{{cite magazine}}: CS1 maint: multiple names: authors list () - ↑ 6,0 6,1 6,2 6,3 Luzzio, F.A. (2001). „The Henry Reaction: recent examples“. Tetrahedron. 57-jild, № 22. 915–945-bet. doi:10.1002/chin.200122233.
- ↑ Reich. „Bordwell pKa table: "Nitroalkanes"“. University of Wisconsin Chemistry Department. Qaraldi: 17-yanvar 2016-yil.
- ↑ Matthews, Walter; et al. (1975). „Equilibrium acidities of carbon acids. VI. Establishment of an absolute scale of acidities in dimethyl sulfoxide solution“. Journal of the American Chemical Society. 97-jild, № 24. 7006-bet. doi:10.1021/ja00857a010.
- ↑ Bersohn, Malcolm (1961). „C versus O Alkylation in the Case of a Stable Cation“. J. Am. Chem. Soc. 83-jild, № 9. 2136–2138-bet. doi:10.1021/ja01470a022.
- ↑ Begona, L., Arrieta, A., Morao, I., Cossio, F.P. (1997). „Ab Initio Models for the Nitroaldol (Henry) Reaction“. Chem. Eur. J. 3-jild, № 1. 20–28-bet. doi:10.1002/chem.19970030105.
{{cite magazine}}: CS1 maint: multiple names: authors list () - ↑ Sasai, Hiroaki; Suzuki, Takeyuki; Arai, Shigeru; Arai, Takayoshi; Shibasaki, Masakatsu (1-may 1992-yil). „Basic character of rare earth metal alkoxides. Utilization in catalytic carbon-carbon bond-forming reactions and catalytic asymmetric nitroaldol reactions“. Journal of the American Chemical Society. 114-jild, № 11. 4418–4420-bet. doi:10.1021/ja00037a068.
{{cite magazine}}: CS1 maint: date format () - ↑ 12,0 12,1 12,2 List et al. described this process as the organocatalyst functioning as Lewis acid or base or Brønsted acid or base.
- ↑ Westermann, B. (2003). „Asymmetric catalytic aza-Henry reactions leading to 1,2-diamines and 1,2-diaminocarboxylic acids“. Angew. Chem. Int. Ed. Engl. 42-jild, № 2. 151–153-bet. doi:10.1002/anie.200390071. PMID 12532343.
- ↑ Seayad, J., List, B. (2005). „Asymmetric organocatalysis“. Org. Biomol. Chem. 3-jild, № 5. 719–724-bet. doi:10.1039/b415217b. PMID 15731852.
{{cite magazine}}: CS1 maint: multiple names: authors list () - ↑ Menzel, A., Ohrlein, R., Griesser, H., Wehner, V., Jager, V. (1999). „A Short Synthesis of L-Acosamine Based on Nitroaldol Addition (Henry Reaction). Analysis of the Key Step Concerning Solvent and Temperature Effects“. Synthesis. 9-jild, № 45. 1691–1702-bet. doi:10.1002/chin.199945325.
{{cite magazine}}: CS1 maint: multiple names: authors list () - ↑ Palomo, Claudio; Oiarbide, Mikel; Laso, Antonio (2005). „Enantioselective Henry Reactions under Dual Lewis Acid/Amine Catalysis Using Chiral Amino Alcohol Ligands“. Angewandte Chemie. 44-jild, № 25. 3881–3884-bet. doi:10.1002/anie.200463075. PMID 15892142.
- ↑ Alcaide, Benito; Almendros, Pedro; Luna, Amparo; Paz de Arriba, M.; Rosario Torresc, M. (2007). „Organocatalyzed diastereoselective Henry reaction of enantiopure 4-oxoazetidine-2-carbaldehydes“ (PDF). Arkivoc. 2007-jild, № iv. 285–296-bet. doi:10.3998/ark.5550190.0008.425.
- ↑ Gogoi, N., Boruwa, J., Barua, N.C. (2005). „A total synthesis of (–)-bestatin using Shibasaki's asymmetric Henry reaction“. Tetrahedron Letters. 46-jild, № 44. 7581–7582-bet. doi:10.1016/j.tetlet.2005.08.153.
{{cite magazine}}: CS1 maint: multiple names: authors list () - ↑ Marcelli, T., van der Haas, R., van Maarseveen, J.H., Hiemstra, H. (2006). „Asymmetric Organocatalytic Henry Reaction“. Angew. Chem. Int. Ed. 45-jild, № 6. 929–931-bet. doi:10.1002/anie.200503724. PMID 16429453.
{{cite magazine}}: CS1 maint: multiple names: authors list () - ↑ Purkarthofer, T., Gruber, K., Gruber-Khadjawi, M., Waich, K., Skranc, W., Mink, D. and Griengl, H. (2006). „A Biocatalytic Henry Reaction—The Hydroxynitrile Lyase from Hevea brasiliensis Also Catalyzes Nitroaldol Reactions“. Angewandte Chemie. 45-jild, № 21. 3454–3456-bet. doi:10.1002/anie.200504230. PMID 16634109.
{{cite magazine}}: CS1 maint: multiple names: authors list () - ↑ „Synthesis of (R)-β-nitro alcohols catalyzed by R-selective hydroxynitrile lyase from Arabidopsis thaliana in the aqueous-organic biphasic system“. J. Biotechnol. 153-jild, № 3–4. 2011. 153–159-bet. doi:10.1016/j.jbiotec.2011.03.011. PMID 21439333.


