Perflorobutansulfonil ftorid
Perflorobutansulfonil ftorid (noaftorobutansulfonil ftorid, NfF) rangsiz, uchuvchi suyuqlik bo'lib, suv bilan aralashmaydi, lekin oddiy organik erituvchilarda eriydi. U sulfolanning elektrokimyoviy florlanishi bilan tayyorlanadi. NfF palladiy katalizlangan oʻzaro bogʻlanish reaksiyalarida elektrofillar sifatida qimmatli boʻlgan nonafluorobutansulfonatlar (nonaflatlar) uchun kirish nuqtasi boʻlib xizmat qiladi. Perfluoroalkilsulfonilatuvchi vosita sifatida NfF tez-tez ishlatiladigan triflik angidridga nisbatan arzonroq narx va yuqori barqarorlik afzalliklarini taklif etadi. Ftorid qoldiradigan guruh aminlar, fenoksidlar va enolatlar kabi nukleofillar bilan osongina almashtiriladi va mos ravishda sulfanilamidlar, aril nonaflatlar va alkenil nonaflatlarni beradi. Biroq, u suv tomonidan hujumga uchramaydi (bunda u pH<12 da barqaror). Bariy gidroksid bilan gidroliz natijasida Ba(ONf)2 hosil bo'ladi, bu esa sulfat kislota bilan ishlov berilganda perftorobutansulfonik kislota va erimaydigan bariy sulfatni beradi.
Tozalash
[tahrir | manbasini tahrirlash]
Savdoda mavjud bo'lgan NfF 6-10 mol /%bilan ifloslangan Uning ishlab chiqarilishidan olingan perfluorosulfolan. Bu tijorat materialini K3PO4 va K2HPO4 ning konsentrlangan suvli eritmasi bilan 1: 1 molyar nisbatda 96 soat davomida kuchli aralashtirish orqali osonlikcha olib tashlanadi. Ushbu davolash, keyin suvli qatlamni olib tashlash va P 2 O 5 dan distillash, Miqdoriy tiklanishga yaqin NfF.[1]> 99 mol/ % ni o'z ichiga olgan mahsulotni beradi.
Aril va alkenil nonaflatlarning sintezi
[tahrir | manbasini tahrirlash]Yuqorida aytib o'tilganidek, aril va alkenil nonaflatlar palladiy katalizlangan o'zaro bog'lanish reaktsiyalarida elektrofil sifatida foydalidir. Ularning reaktivligi odatda ko'proq uchraydigan triflat elektrofillarini aks ettiradi, ammo nonaflatlar ketonlarga (alkenil sulfonatlar uchun) va fenollarga (aril sulfonatlar uchun) gidrolizga kamroq moyil bo'ladi. Ularning gidrolizga chidamliligi nonaflatlarni Buchvald-Xartvig muftalarida ustun elektrofillarga aylantiradi, bunda bu yon reaksiya istalgan mahsulotning hosildorligiga salbiy ta'sir ko'rsatishi mumkin.[2]
-ketoesterlarning natriy enolatlari 1,15 ekvivalent NfF bilan reaksiyaga kirishib, yuqori mahsuldorlikda mos keladigan alkenil nonaflatlarni beradi. Etil 2-metilasetoatsetat (R=R'=Me) bu usul bilan geometrik toza E izomerini beradi.[3]
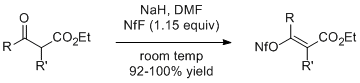
Oddiy aldegidlar va ketonlar DBU yoki fosfazen kabi asoslar ishtirokida NfF bilan reaksiyaga kirishib, diskret enolat hosil qilmasdan yuqori rentabellikda alkenil nonaflatlarni beradi. P 2 fosfazen bazasidan -30 dan -20 °C gacha foydalanish nosimmetrik almashtirilmagan ketonlar bilan kamroq almashtirilgan alkenil nonaflatni beradi.[1] Triflik angidrid bilan shunga o'xshash reaktsiyalar odatda yuqori rentabellikka erishish uchun qimmat 2,6- ditert -butilpiridindan foydalanishni talab qiladi.
Enolatlarning NfF bilan reaksiyasi enolatning tuzilishiga ham, uning metall qarshi ioniga ham kuchli bog'liqdir. Metil ketonlarning litiy enolatlari enolatning O (kutilgan) yoki C (kutilmagan) atomlariga elektrofil hujumi natijasida hosil bo'lgan mahsulotlarning aralashmalarini beradi. Bu ta'sir, ayniqsa, pinakolonning litiy enolati bilan yaqqol namoyon bo'ladi, bu esa C-hujumini qo'llab-quvvatlaydigan 2: 1 aralashmani beradi. Ko'proq almashtirilgan lityum enolatlar o'zgaruvchan rentabellikda faqat O sulfonillanish mahsulotlarini beradi.[4]
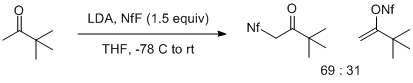
Trimetilsilil enol efirlari NfF bilan 0. °C da substoixiometrik ftorid manbai ishtirokida reaksiyaga kirishadi Alkenil nonaflatlarni o'rtacha va yaxshi hosil qilish uchun atrof-muhit haroratiga. Dried Bu 4 F bir tadqiqotda afzal qilingan ftorid manbai bo'lgan[4], ammo CsF qiyin holatlarda ajoyib natijalar bilan ishlatilgan.[5]

Aril nonaflatlarni kaliy karbonat[6] va Et<sub id="mwUg">3</sub>N[2] kabi asoslar ishtirokida fenollar va NfF dan to'g'ridan-to'g'ri miqdoriy hosildorlikda tayyorlash mumkin. NaH va BuLi[7] kabi kuchliroq asoslardan ham foydalanish mumkin, ammo ular biroz pastroq hosil beradi.
Spirtlar bilan reaksiya
[tahrir | manbasini tahrirlash]NfF ning spirtlar bilan reaksiyasi alkil nonaflatlarning labilligini ta'kidlaydi - ko'p hollarda reaksiyaning yakuniy mahsuloti alkil ftoriddir (F - oraliq alkil nonaflatga hujumidan) yoki olefindir (oraliq mahsulotdan NfOH ning yo'q qilinishidan). bo'lmagan).
Bis -nonafluorobutansulfonimid (Nf2NH) sintezi
[tahrir | manbasini tahrirlash]NfF ammoniy xlorid bilan asetonitrilda trietilamin ishtirokida reaksiyaga kirishib, 97% unumda oʻta kislotali bis -nonaftorobutansulfonimidning trietilamoniy tuzini beradi. Tegishli kaliy tuzi trietilamoniy tuzining metanolik eritmasini KOH bilan davolash orqali olinadi.[8] Kislota statsionar faza sifatida Amberlite IR-100 va eluent sifatida metanol bilan trietilamonium tuzining ion almashinish xromatografiyasi orqali olinadi.[9] Oxirgi protsedurada ishlab chiqarilgan haqiqiy turlar, ehtimol, MeOH 2 + Nf 2 N -.
Manbalar
[tahrir | manbasini tahrirlash]- ↑ 1,0 1,1 Vogel, Michael A. K.; Christian B. W. Stark; Ilya M. Lyapkalo (2007). „A Straightforward Synthesis of Alkenyl Nonaflates from Carbonyl Compounds Using Nonafluorobutane-1-sulfonyl Fluoride in Combination with Phosphazene Bases“. Synlett. 2007-jild, № EFirst. 2907–2911-bet. doi:10.1055/s-2007-991084. ISSN 0936-5214.
- ↑ 2,0 2,1 Meadows, Rebecca E.; Simon Woodward (2008-02-11). „Steric effects in palladium-catalysed amination of aryl triflates and nonaflates with the primary amines PhCH(R)NH2 (R=H, Me)“. Tetrahedron. 64-jild, № 7. 1218–1224-bet. doi:10.1016/j.tet.2007.11.074. ISSN 0040-4020.
- ↑ Bellina, Fabio; Donatella Ciucci; Renzo Rossi; Piergiorgio Vergamini (1999-02-12). „Synthesis of vinyl nonaflates derived from β-ketoesters, β-diketones or α-diketones and their palladium-catalyzed cross-coupling reactions with organozinc halides“. Tetrahedron. 55-jild, № 7. 2103–2112-bet. doi:10.1016/S0040-4020(98)01221-6. ISSN 0040-4020.
- ↑ 4,0 4,1 Lyapkalo, Ilya M.; Matthias Webel; Hans-Ulrich Reißig (2002). „An Expedient and Stereoselective Synthesis of Alkenyl Nonaflates from Silyl Enol Ethers: Optimization, Scope and Limitations“. European Journal of Organic Chemistry. 2002-jild, № 6. 1015–1025-bet. doi:10.1002/1099-0690(200203)2002:6<1015::AID-EJOC1015>3.0.CO;2-K. ISSN 1099-0690.
- ↑ Bräse, Stefan (1999). „Synthesis of Bis(enolnonaflates) and their 4-exo-trig-Cyclizations by Intramolecular Heck Reactions“. Synlett. 1999-jild, № 10. 1654–1656-bet. doi:10.1055/s-1999-2892. ISSN 0936-5214.
- ↑ Shekhar, Shashank; Travis B. Dunn; Brian J. Kotecki; Donna K. Montavon; Steven C. Cullen (2011). „A General Method for Palladium-Catalyzed Reactions of Primary Sulfonamides with Aryl Nonaflates“. J. Org. Chem. 76-jild, № 11. 4552–4563-bet. doi:10.1021/jo200443u. ISSN 0022-3263. PMID 21510695.
- ↑ Uemura, Minoru; Hideki Yorimitsu; Koichiro Oshima (2008-02-18). „Cp∗Li as a base: application to palladium-catalyzed cross-coupling reaction of aryl-X or alkenyl-X (X=I, Br, OTf, ONf) with terminal acetylenes“. Tetrahedron. 64-jild, № 8. 1829–1833-bet. doi:10.1016/j.tet.2007.11.095. ISSN 0040-4020.
- ↑ Quek, Ser Kiang; Ilya M. Lyapkalo; Han Vinh Huynh (2006-03-27). „Synthesis and properties of N,N′-dialkylimidazolium bis(nonafluorobutane-1-sulfonyl)imides: a new subfamily of ionic liquids“. Tetrahedron. 62-jild, № 13. 3137–3145-bet. doi:10.1016/j.tet.2006.01.015. ISSN 0040-4020.
- ↑ Hashmi, A. Stephen K.; Tobias Hengst; Christian Lothschütz; Frank Rominger (2010). „New and Easily Accessible Nitrogen Acyclic Gold(I) Carbenes: Structure and Application in the Gold-Catalyzed Phenol Synthesis as well as the Hydration of Alkynes“. Advanced Synthesis & Catalysis. 352-jild, № 8. 1315–1337-bet. doi:10.1002/adsc.201000126. ISSN 1615-4169.

