Suvning elektrolizi

Suvning elektrolizi, elektrokimyoviy dissotysatsiyasi deb nomlanuvchi, elektroliz deb ataladigan jarayon bo'lib suvni kislorod va vodorod gaziga parchalash uchun elektr energiyasidan foydalanish jarayonidir. Shu tarzda chiqarilgan vodorod gazini vodorod yoqilg'isi sifatida ishlatish yoki kislorod bilan qayta aralashtirish orqali payvandlash va metallarni ranglashda qoʻllanadi.
Suvni elektroliz qilish uchun minimal potentsial farq 1,23 voltni talab qiladi, ammo bu kuchlanishda atrof-muhitdan tashqi issiqlik talab qilinadi. Shu sababli, minimum energiya talab qilinadi.
Tarixi
[tahrir | manbasini tahrirlash]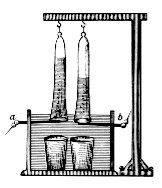
1789-yilda Yan Rudolf Deyman va Adrian Paets van Troostwijk elektrostatik mashinadan foydalanib, Leyden idishidagi oltin elektrodlarda suv bilan zaryadlangan elektr energiyasini ishlab chiqarishdi. 1800-yilda Alessandro Volta voltaik qoziqni ixtiro qildi va bir necha hafta o'tgach, ingliz olimlari Uilyam Nikolson va Entoni Karlayl uni suvni elektroliz qilish uchun ishlatishdi. 1806-yilda Xamfri Davi distillangan suv elektrolizining keng ko'lamli eksperimentlari natijalarini e'lon qildi va anodda erigan atmosfera azot gazidan azot kislotasi ishlab chiqarilgan degan xulosaga keldi. U yuqori kuchlanishli akkumulyator va reaktiv bo'lmagan elektrodlar va nam asbest bilan ko'prikli idishlar sifatida ikki baravar ko'payadigan oltin elektrod konuslari kabi idishlardan foydalangan.[1] 1869-yilda Zenobe Gramme Gramme mashinasini ixtiro qilganida, suvni elektroliz qilish vodorod ishlab chiqarishning arzon usuliga aylandi. Elektroliz orqali vodorod va kislorodni sanoat sintezi usuli 1888-yilda Dmitriy Lachinov tomonidan ishlab chiqilgan.
Prinsipi
[tahrir | manbasini tahrirlash]To'g'ridan-to'g'ri elektr quvvat manbai ikkita elektrodga yoki suvga joylashtirilgan ikkita plastinkaga (odatda platina yoki iridiy kabi inert metalldan qilingan) ulanadi. Vodorod katodda (elektronlar suvga kiradigan joyda), kislorod esa anodda paydo bo'ladi.[2] Ideal faradaik samaradorlikni hisobga olsak, hosil bo'lgan vodorod miqdori kislorod miqdoridan ikki baravar ko'pdir va ikkalasi ham eritma tomonidan o'tkaziladigan umumiy elektr zaryadiga proportsionaldir.[3] Biroq, ko'plab hujayralarda raqobatdosh yon reaksiyalar yuzaga keladi, natijada turli xil mahsulotlar va ideal faradaik samaradorlikdan kamroq bo'ladi.
Toza suvning elektrolizi turli faollashuv to'siqlarini bartaraf etish uchun ortiqcha potentsial ko'rinishida ortiqcha energiya talab qiladi. Ortiqcha energiya bo'lmasa, toza suvning elektrolizi juda sekin yoki umuman sodir bo'lmaydi. Bu qisman suvning cheklangan o'z-o'zidan ionlanishi bilan bog'liq . Toza suvning elektr o'tkazuvchanligi dengiz suvining milliondan bir qismiga teng. Ko'pgina elektrolitik hujayralar ham zarur elektrokatalizatorlardan mahrum bo'lishi mumkin. Elektrolizning samaradorligi elektrolitlar (masalan, tuz, kislota yoki asos) qo'shilishi va elektrokatalizatorlardan foydalanish orqali oshiriladi.
Hozirgi vaqtda elektrolitik jarayon sanoatda kamdan-kam qoʻllanadi, chunki vodorodni qazib olinadigan yoqilg'idan arzonroq ishlab chiqarish mumkin.[4]
Tenglamalari
[tahrir | manbasini tahrirlash]
Manfiy zaryadlangan katoddagi toza suvda qaytarilish reaksiyasi sodir boʻladi, katoddan elektronlar (e -) vodorod kationlariga vodorod gazini hosil qiladi. Kislota bilan muvozanatlangan yarim reaksiya quyidagicha:
- Katodda pasayish: 2 H + (aq) + 2e - → H 2 (g)
Musbat zaryadlangan anodda oksidlanish reaksiyasi sodir bo'lib, kislorod gazini hosil qiladi va kontaktlarning zanglashiga olib kirish uchun elektronlarni anodga beradi:
- EAnodda oksidlanish: 2 H 2 O(l) → O 2 (g) + 4 H + (aq) + 4e -
Termodinamikasi
[tahrir | manbasini tahrirlash]Standart sharoitda suvni elektroliz qilish uchun har bir mol suvni dissotsiatsiya qilish uchun nazariy minimal 237 kJ elektr energiyasi talab qilinadi, bu suv hosil bo'lishining standart Gibbs erkin energiyasidir . Bundan tashqari, reaksiya entropiyasining o'zgarishini bartaraf etish uchun energiya kerak. Shuning uchun, tashqi issiqlik/energiya qo'shilmasa, jarayon har mol uchun 286 kJ dan past davom eta olmaydi.
Har bir mol suv ikki mol elektronni talab qilganligi sababli va Faraday doimiysi F bir mol elektronning zaryadini (96485 C/mol) ifodalashini hisobga olsak, elektroliz uchun zarur bo'lgan minimal kuchlanish taxminan 1,23 V ni tashkil qiladi.[5] Agar elektroliz yuqori haroratda amalga oshirilsa, bu kuchlanish kamayadi. Bu elektrolizatorning 100% dan ortiq elektr samaradorligi bilan samarali ishlashiga imkon beradi. Elektrokimyoviy tizimlarda bu reaksiyani davom ettirish uchun reaktorga issiqlik berilishi kerakligini anglatadi. Shu tarzda issiqlik energiyasi elektroliz energiyasiga bo'lgan ehtiyojning bir qismi uchun ishlatilishi mumkin.[6] Xuddi shunday yo'l bilan yoqilg'i (uglerod, spirt, biomassa kabi) suv (past haroratda PEM asosidagi elektrolizator) yoki kislorod ionlari (yuqori haroratda qattiq oksid elektrolitlari asosidagi elektrolizator) bilan reaksiyaga kirishsa, kerakli kuchlanishni (1 V dan past) kamaytirish mumkin.). Bu yoqilg'i energiyasining bir qismini elektroliz jarayoniga "yordam berish" uchun sarflanishiga olib keladi va ishlab chiqarilgan vodorodning umumiy tannarxini kamaytirishi mumkin.[7]
Manbalar
[tahrir | manbasini tahrirlash]- ↑ „On Some Chemical Agencies of Electricity“, The Collected Works of Sir Humphry Davy Davy: , 1839 — 1–12-bet.
- ↑ Zumdahl, Steven S.. Chemistry, 9th, Cengage Learning, 1 January 2013 — 30-bet. ISBN 978-1-13-361109-7.
- ↑ Carmo, M; Fritz D; Mergel J; Stolten D (2013). „A comprehensive review on PEM water electrolysis“. Journal of Hydrogen Energy. 38-jild, № 12. 4901–4934-bet. doi:10.1016/j.ijhydene.2013.01.151.
- ↑ „Hydrogen Basics — Production“. Florida Solar Energy Center (2007). 2008-yil 18-fevralda asl nusxadan arxivlangan. Qaraldi: 2008-yil 5-fevral.
- ↑ Hyman D. Gesser. Applied Chemistry. Springer, 2002 — 16–-bet. ISBN 978-0-306-46700-4. Qaraldi: 2011-yil 18-dekabr.
- ↑ Badwal, Sukhvinder P.S.; Giddey, Sarbjit; Munnings, Christopher (September 2013). „Hydrogen production via solid electrolytic routes“. Wiley Interdisciplinary Reviews: Energy and Environment. 2-jild, № 5. 473–487-bet. doi:10.1002/wene.50.
- ↑ Badwal, Sukhvinder P. S.; Giddey, Sarbjit S.; Munnings, Christopher; Bhatt, Anand I.; Hollenkamp, Anthony F. (24 September 2014). „Emerging electrochemical energy conversion and storage technologies (open access)“. Frontiers in Chemistry. 2-jild. 79-bet. Bibcode:2014FrCh....2...79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
