Yogʻ kislotalari sintezi
Biokimyoda yogʻ kislotalari sintezi yogʻ kislotasi sintazalari deb ataladigan fermentlar taʼsirida atsetil -KoA va NADPH dan yogʻ kislotalarini yaratishdir. Bu jarayon hujayra sitoplazmasida sodir boʻladi. Yogʻ kislotalariga aylanadigan atsetil-KoA ning koʻp qismi glikolitik yoʻl orqali uglevodlardan olinadi. Glikolitik yoʻl shuningdek, uchta yogʻ kislotasi triglitseridlarni (shuningdek, "triatsilgliserollar" deb ham ataladi) hosil qilish uchun birlashishi mumkin boʻlgan glitserinni (efir bogʻlari orqali) taʼminlaydi. lipogen jarayonning yakuniy mahsuloti. Faqat ikkita yogʻ kislotasi glitserin bilan birlashganda va uchinchi alkogol guruhi fosfatidilxolin kabi bir guruh bilan fosforlanganda fosfolipid hosil boʻladi. Fosfolipidlar hujayra membranalarini tashkil etuvchi va hujayra ichidagi organellalarni (masalan, hujayra yadrosi, mitoxondriya, endoplazmatik retikulum, Golji apparati va boshqalar) oʻrab turgan lipid ikki qatlamlarining asosiy qismini tashkil qiladi.
Tarmoqlangan zanjirli yogʻ kislotalari
[tahrir | manbasini tahrirlash]Toʻgʻri zanjirli yogʻ kislotalari ikki xil boʻladi: toʻyingan va toʻyinmagan.
Toʻyingan toʻgʻri zanjirli yogʻ kislotalari
[tahrir | manbasini tahrirlash]
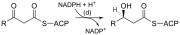
B-oksidlanishga oʻxshab, toʻgʻri zanjirli yogʻ kislotalari sintezi 16 uglerodli palmitik kislota hosil boʻlgunga qadar quyida koʻrsatilgan oltita takroriy reaksiyalar orqali sodir boʻladi.[1][2]
Taqdim etilgan diagrammalar yogʻ kislotalarining mikroorganizmlarda qanday sintezlanishini koʻrsatadi va ichak tayoqchasida topilgan fermentlarni sanab oʻtadi.[1] Ushbu reaksiyalar yogʻ kislotasi sintaza II (FASII) tomonidan amalga oshiriladi, ular odatda bitta kompleks sifatida ishlaydigan bir nechta fermentlarni oʻz ichiga oladi. FASII prokaryotlar, oʻsimliklar, zamburugʻlar va parazitlarda, shuningdek, mitoxondriyalarda mavjud.[3]
Hayvonlarda, shuningdek, xamirturush kabi baʼzi zamburugʻlarda xuddi shunday reaksiyalar yogʻ kislotasi sintezi I (FASI), yogʻ kislotasini yaratish uchun zarur boʻlgan barcha fermentativ faollikka ega boʻlgan katta dimerik oqsilda sodir boʻladi. FASII FASIga qaraganda samaraliroq; ammo, bu zanjirning erta tugashi orqali koʻproq molekulalarni, shu jumladan "oʻrta zanjirli" yogʻ kislotalarini shakllantirishga imkon beradi.[3]
16:0 uglerodli yogʻ kislotasi hosil boʻlgandan soʻng, u bir qator oʻzgarishlarga duchor boʻlishi mumkin, natijada desaturatsiya va / yoki choʻziladi. Stearat bilan boshlangan choʻzilish (18:0), asosan ERda bir nechta membrana bilan bogʻlangan fermentlar tomonidan amalga oshiriladi. Choʻzilish jarayonida ishtirok etadigan fermentativ bosqichlar, asosan, FAS tomonidan amalga oshiriladigan bosqichlar bilan bir xil, ammo choʻzilishning toʻrtta asosiy ketma-ket bosqichi jismoniy jihatdan bogʻliq boʻlishi mumkin boʻlgan alohida oqsillar tomonidan amalga oshiriladi.[4][5]
Eʼtibor bering, yogʻ sintezi paytida qaytaruvchi vosita NADPH, NAD esa beta-oksidlanishda (yogʻ kislotalarining atsetil-KoA ga parchalanishi) oksidlovchi vositadir. Bu farq NADPH biosintetik reaksiyalar paytida isteʼmol qilinadi, NADH esa energiya hosil qiluvchi reaksiyalarda hosil boʻlishining umumiy tamoyiliga misoldir.[6] (Shunday qilib, NADPH atsetil-KoA dan xolesterin sintezi uchun ham talab qilinadi; NADH esa glikoliz jarayonida hosil boʻladi.) NADPH ning manbai ikki tomonlama. Malat piruvat hosil qilish uchun "NADP + - bollangan molik ferment" tomonidan oksidlovchi dekarboksillanganda CO va NADPH hosil boʻladi. NADPH shuningdek, glyukozani nukleotidlar va nuklein kislotalar sintezida ishlatilishi mumkin boʻlgan ribozaga aylantiradigan pentoza fosfat yoʻli orqali hosil boʻladi yoki piruvatga katabolizatsiya qilinishi mumkin.[6]
Uglevodlarni yogʻ kislotalariga aylantirish
[tahrir | manbasini tahrirlash]Odamlarda yogʻ kislotalari asosan uglevodlardan jigar va yogʻ toʻqimalarida, shuningdek, laktatsiya davrida sut bezlarida hosil boʻladi.
Glikoliz natijasida hosil boʻlgan piruvat uglevodlarni yogʻ kislotalari va xolesteringa aylantirishda muhim vositachi hisoblanadi.[6] Bu mitoxondriyadagi piruvatni atsetil-KoA ga aylantirish orqali sodir boʻladi. Biroq, bu atsetil KoA yogʻ kislotalari va xolesterin sintezi sodir boʻladigan sitozolga oʻtkazilishi kerak. Bu bevosita sodir boʻlishi mumkin emas. Sitozolik atsetil-KoA ni olish uchun sitrat (atsetil KoA ning oksaloatsetat bilan kondensatsiyasi natijasida hosil boʻladi) limon kislotasi siklidan chiqariladi va ichki mitoxondriyal membrana orqali sitozolga oʻtkaziladi.[6] U yerda u ATP sitrat liazasi tomonidan atsetil-KoA va oksaloatsetatga boʻlinadi. Oksaloatsetat glyukoneogenez (jigarda) uchun ishlatilishi mumkin yoki u mitoxondriyaga malat shaklida qaytarilishi mumkin.[7] Sitozolik asetil-KoA asetil CoA karboksilaza tomonidan malonil KoA ga karboksillanadi, bu yogʻ kislotalari sintezidagi birinchi qadamdir.[7][8]
Hayvonlar yogʻ kislotalaridan uglevodlarni qayta sintez qila olmaydi
[tahrir | manbasini tahrirlash]Hayvonlarning tanasida saqlanadigan asosiy yoqilgʻi yogʻdir. Voyaga etgan odamning yogʻ zaxiralari oʻrtacha 15–20 kg (33–44 lb) gacha, lekin yoshi, jinsi va individual moyilligiga qarab katta farq qiladi.[9] Bundan farqli oʻlaroq, inson tanasi atigi 400 g (0.88 lb) dona saqlaydi glikogen, shundan 300 g (0.66 lb) skelet mushaklari ichida qulflangan va umuman tanada mavjud emas. 100 g (0.22 lb) yoki shunga oʻxshash jigarda saqlanadigan glikogen ochlikdan keyin bir kun ichida tugaydi.[10] Shundan soʻng, tana toʻqimalari tomonidan umumiy foydalanish uchun jigar tomonidan qonga chiqariladigan glyukoza glyukogen aminokislotalardan va yogʻ kislotalari boʻlmagan bir qancha boshqa glyukoneogen substratlardan sintezlanishi kerak.[11]
Yogʻ kislotalari mitoxondriya ichida beta-oksidlanish yoʻli bilan atsetil-KoA ga parchalanadi, yogʻ kislotalari esa mitoxondriya tashqarisida, sitozolda atsetil-KoA dan sintezlanadi. Ikki yoʻl nafaqat ular sodir boʻlgan joyda, balki sodir boʻladigan reaksiyalarda va ishlatiladigan substratlarda ham farqlanadi. Ikkala yoʻl oʻzaro ingibitiv boʻlib, beta-oksidlanish natijasida hosil boʻlgan atsetil-KoA ning atsetil-KoA karboksilaza reaksiyasi orqali sintetik yoʻlga kirishiga toʻsqinlik qiladi.[11] Uni piruvatga aylantirib boʻlmaydi, chunki piruvat dekarboksillanish reaksiyasi qaytmasdir.[10] Buning oʻrniga limon kislotasi aylanishiga kirish uchun oksaloasetat bilan kondensatsiyalanadi. Siklning har bir aylanishida ikkita uglerod atomi izotsitrat degidrogenaza va alfa-ketoglutarat degidrogenaza tomonidan katalizlangan dekarboksillanish reaksiyalarida CO shaklida siklni tark etadi. Shunday qilib, limon kislotasi siklining har bir aylanishi atsetil-KoA birligini oksidlaydi, shu bilan birga atsetil-KoA dastlab limon kislotasini hosil qilish uchun birlashgan oksaloatsetat molekulasini qayta tiklaydi. Dekarboksillanish reaksiyalari siklda malat hosil bo'lishidan oldin sodir boʻladi. Malat - bu mitoxondriyadan olib tashlanishi mumkin boʻlgan yagona moddadir, bu jigarda yoki boshqa toʻqimalarda glyukoza yoki glikogen hosil qilish uchun glyukoneogen yoʻlga kiradi.[11] Shuning uchun yogʻ kislotalarining glyukozaga aniq aylanishi mumkin emas.
Faqat oʻsimliklarda atsetil-KoA-ni oksaloatsetatga aylantirish uchun fermentlar mavjud boʻlib, undan malat hosil boʻlishi va natijada glyukozaga aylanishi mumkin.[11]
- Reglament
Atsetil-KoA atsetil -KoA karboksilaza taʼsirida malonil-KoA ga hosil boʻladi, bunda malonil-KoA yogʻ kislotasi sintezi yoʻliga oʻtish uchun moʻljallangan. Asetil-KoA karboksilaza toʻyingan toʻgʻri zanjirli yogʻ kislotalari sintezida tartibga solish nuqtasi boʻlib, fosforlanish va allosterik regulyatsiyaga boʻysunadi . Fosforlanish bilan tartibga solish asosan sutemizuvchilarda, allosterik regulyatsiya esa koʻpchilik organizmlarda sodir boʻladi. Allosterik nazorat palmitoil-KoA tomonidan teskari aloqani inhibe qilish va sitrat bilan faollashuv sifatida sodir bo'ladi. Toʻyingan yogʻ kislotalari sintezining yakuniy mahsuloti boʻlgan palmitoil-KoA yuqori darajada bʼlsa, u hujayralardagi yogʻ kislotalarining toʻplanishini oldini olish uchun atsetil-KoA karboksilazasini allosterik ravishda inaktiv qiladi. Sitrat yuqori darajada atsetil-KoA karboksilazasini faollashtiradi, chunki yuqori darajalar Krebs tsikliga kirish va energiyani tejash uchun etarli darajada atsetil-KoA mavjudligini koʻrsatadi.[12]
Qon plazmasidagi insulinning yuqori plazma darajasi (masalan, ovqatdan keyin) atsetil-KoA karboksilazaning fosforillanishiga olib keladi, shu bilan atsetil-KoA dan malonil-KoA hosil boʻlishiga va natijada uglevodlarning yogʻ kislotalariga, epinefrin va glyukagonga aylanishiga yordam beradi. (ochlik va jismoniy mashqlar paytida qonga chiqariladi) bu fermentning fosforlanishiga olib keladi, beta-oksidlanish orqali yogʻ kislotasi oksidlanishi foydasiga lipogenezni inhibe qiladi.[6][8]
Toʻyinmagan toʻgʻri zanjirli yogʻ kislotalari
[tahrir | manbasini tahrirlash]Anaerob desaturatsiya
[tahrir | manbasini tahrirlash]Koʻpgina bakteriyalar toʻyinmagan yogʻli kislotalarni sintez qilish uchun anaerob yoʻldan foydalanadilar. Bu yoʻl kisloroddan foydalanmaydi va normal yogʻ kislotasi sintezi mexanizmidan foydalangan holda choʻzilishdan oldin qoʻsh bogʻlanishni kiritish uchun fermentlarga bogʻliq. Escherichia coli da bu yoʻl yaxshi tushuniladi.

- FabA b-gidroksidekanoil-ACP degidrazasi bo'lib, u 10-uglerodli to'yingan yog' kislotalari sintezi oraliq mahsuloti (b-gidroksidekanoil-ACP) uchun xosdir.
- FabA b-gidroksidekanoil-ACP ning suvsizlanishini katalizlaydi, bu esa suvning chiqishi va metil uchidan hisoblangan C7 va C8 o'rtasida qo'sh bog'lanishning kiritilishiga olib keladi. Bu trans-2-decenoyl oraliq mahsulotini yaratadi.
- Trans-2-decenoyl oraliq mahsuloti FabB tomonidan normal to'yingan yog' kislotasi sintezi yo'liga o'tishi mumkin, bu yerda qo'sh bog' gidrolizlanadi va yakuniy mahsulot to'yingan yog' kislotasi bo'ladi yoki FabA izomerizatsiyani cis-ga katalizlaydi. 3-decenoil oraliq mahsulot.
- FabB b-ketoatsil-ACP sintaza bo'lib, u cho'ziladi va oraliq moddalarni asosiy yog' kislotalari sintezi yo'liga yo'naltiradi. FabB cis-decenoyl oraliq mahsuloti bilan reaksiyaga kirishganda, cho'zilgandan keyin yakuniy mahsulot to'yinmagan yog'li kislota bo'ladi.[13]
- Tayyorlangan ikkita asosiy to'yinmagan yog'li kislotalar Palmitoleoyl-ACP (16:1ō7) va cis-vaccenoyl-ACP (18:1ō7).[14]
Anaerob desaturatsiyaga uchragan ko'pchilik bakteriyalar FabA va FabB gomologlarini o'z ichiga oladi.[15] Clostridia asosiy istisno hisoblanadi; ularda cis qo'sh bog'lanish hosil bo'lishini katalizlovchi, hali aniqlanmagan yangi ferment mavjud.[14]
- Reglament
Ushbu yo'l FadR va FabR tomonidan transkripsiyaviy tartibga solinadi. FadR ko'proq o'rganilgan oqsil bo'lib, bifunksional xususiyatlarga ega. U fabA va fabB transkripsiyasining faollashtiruvchisi va b-oksidlanish regulonining repressori sifatida ishlaydi. Bundan farqli o'laroq, FabR fabA va fabB transkripsiyasi uchun repressor vazifasini bajaradi.[13]
Aerobik desaturatsiya
[tahrir | manbasini tahrirlash]Sutemizuvchilarda aerob desaturatsiya uchta membrana bilan bog'langan fermentlar majmuasi (NADH-sitoxrom b 5 reduktaza, sitoxrom b 5 va desaturaza) tomonidan katalizlanadi. Bu fermentlar molekulyar kislorod, O</br> O, to'yingan yog'li asil-CoA zanjiri bilan o'zaro ta'sir qilish, er-xotin bog'lanish va ikkita suv molekulasini hosil qiladi, H</br> H O. Ikki elektron NADH + H+ dan keladiH</br> va ikkitasi yog 'kislotalari zanjiridagi yagona bog'dan.[6] Biroq, bu sutemizuvchilar fermentlari yog 'kislotalari zanjirida C-9 dan tashqari uglerod atomlarida qo'sh bog'lanishni o'rnatishga qodir emas. [nb 1] .) Demak, sutemizuvchilar linoleat yoki linolenat sintez qila olmaydi (ular C-12 (= D 12) yoki mos ravishda C-12 va C-15 (= D 12 va D 15) pozitsiyalarida qoʻsh bogʻlanishga ega, shuningdek, D 9 pozitsiyasi) yoki linoleatdan olingan ko'p to'yinmagan, 20-uglerodli araxidon kislotasi . Bularning barchasi muhim yog 'kislotalari deb ataladi, ya'ni ular organizm tomonidan talab qilinadi, lekin faqat dieta orqali ta'minlanishi mumkin. (Araxidon kislotasi mahalliy gormonlar sifatida juda ko'p funksiyalarni bajaradigan prostaglandinlarning kashshofidir.)[6]
Odd-chain fatty acids
[tahrir | manbasini tahrirlash]Toq zanjirli yog 'kislotalari (OCFAs) toq miqdordagi uglerod atomlarini o'z ichiga olgan yog' kislotalaridir. Eng keng tarqalgan OCFA'lar to'yingan C15 va C17 hosilalari, mos ravishda pentadekanoik kislota va heptadekanoik kislotadir .[16] Juft zanjirli yog 'kislotalari sintezining sintezi atsetil-KoA prekursorlarini yig'ish orqali amalga oshiriladi, ammo uglerod atomlarining toq bo'lgan uzun zanjirli yog' kislotalarining biosintezi uchun primer sifatida atsetil-KoA o'rniga propionil-KoA ishlatiladi.[17]
- Reglament
B. subtilisda bu yo'l ikki komponentli tizim tomonidan tartibga solinadi: DesK va DesR. DesK membrana bilan bog'langan kinaz va DesR des genining transkripsiya regulyatoridir.[7][18] Tartibga solish haroratga javob beradi; harorat pasayganda, bu gen yuqori tartibga solinadi. To'yinmagan yog'li kislotalar membrananing suyuqligini oshiradi va past haroratlarda uni barqarorlashtiradi. DesK - sensorli oqsil bo'lib, harorat pasayganda, avtofosforillanadi. DesK-P o'zining fosforil guruhini DesR ga o'tkazadi. Ikki DesR-P oqsili dimerlanadi va des genining DNK promotorlari bilan bog'lanadi va transkripsiyani boshlash uchun RNK polimerazasini jalb qiladi.[7][18]
Pseudomonas aeruginosa
Umuman olganda, anaerob va aerobik to'yinmagan yog' kislotalari sintezi bir xil tizimda sodir bo'lmaydi, ammo Pseudomonas aeruginosa va Vibrio ABE-1 bundan mustasno.[19][20][21] P. aeruginosa asosan anaerob desaturatsiyaga uchrasa, u ikkita aerob yoʻldan ham oʻtadi. Bir yo'l membrana lipidlarida qo'sh bog'lanish hosil bo'lishini katalizlovchi D 9 -desaturazani (DesA) ishlatadi. Boshqa yo'l DesC va DesB ikkita oqsildan birgalikda D 9 -desaturaz vazifasini bajaradi, bu esa to'yingan yog 'kislotasi-CoA molekulasiga qo'sh bog'lanishni kiritadi. Bu ikkinchi yo'l DesT repressor oqsili tomonidan tartibga solinadi. DesT, shuningdek, ekzogen to'yinmagan yog'li kislotalar mavjud bo'lganda, anaerob desaturatsiya uchun fabAB ifodasini bostiruvchi hisoblanadi. Bu organizm ichidagi ikkita yo'lning ifodasini muvofiqlashtirish vazifasini bajaradi.[20][22]
Tarmoqlangan zanjirli yog 'kislotalari odatda to'yingan va ikkita alohida oilada topiladi: izo-seriya va anteizo-ket. Aniqlanishicha, Actinomycetales o'ziga xos tarmoqli zanjirli yog 'kislotalari sintezi mexanizmlarini o'z ichiga oladi, shu jumladan tuberkulosterik kislota hosil qiladi.
Tarmoqli zanjirli yogʻ kislotalarini sintez qilish tizimi
[tahrir | manbasini tahrirlash]Tarmoqlangan zanjirli yogʻ kislotalarini sintez qilish tizimi primer sifatida a-keto kislotalardan foydalanadi. Ushbu tizim qisqa zanjirli atsil-KoA efirlarini primer sifatida ishlatadigan tarmoqlangan zanjirli yogʻ kislotalari sintetazasidan farq qiladi.[23] a-keto kislotasi primerlari mos ravishda 2-metilpropanil-KoA, 3-metilbutiril-KoA va 2-metilbutiril-KoA hosil qilish uchun valin, leysin va izolösinning transaminatsiyasi va dekarboksillanishidan olinadi.[24] Valindan olingan 2-metilpropanil-KoA primerlari choʻziladi va juft sonli izo-qator yogʻ kislotalarini hosil qiladi, masalan, 14-metil-pentadekanoik (izopalmitik) kislota va leysindan olingan 3-metilbutiril-KoA primerlari hosil boʻlishi uchun ishlatilishi mumkin. 13-metil-tetradekanoik kislota kabi toq sonli izo-seriyali yogʻ kislotalari. Izoleysindan olingan 2-metilbutiril-KoA primerlari choʻzilgan boʻlib, 12-metil tetradekanoik kislota kabi toq sonli uglerod atomlarini oʻz ichiga olgan anteizo-ket yogʻ kislotalarini hosil qiladi.[25] Primer prekursorlarning dekarboksillanishi tarmoqlangan zanjirli a-keto kislota dekarboksilaza (BCKA) fermenti orqali sodir boʻladi. Yogʻ kislotasi choʻzilishi ichak tayoqchasida toʻgʻridan-toʻgʻri zanjirli yogʻ kislotalarini ishlab chiqarish uchun ishlatiladigan biosintetik yoʻl boʻylab boradi, bu yerda malonil-KoA zanjir kengaytiruvchisi sifatida ishlatiladi.[26] Asosiy yakuniy mahsulot 12-17 ta uglerodli tarmoqlangan zanjirli yogʻ kislotalari boʻlib, ularning tarkibi koʻplab bakteriyalar turlari uchun bir xil va xarakterli boʻladi.[25]
BCKA dekarboksilaza va a-keto kislota substratlarining nisbiy faolligi
BCKA dekarboksilaza fermenti tetramerik tuzilishdagi (A 2 B 2) ikkita subbirlikdan tashkil topgan va tarmoqlangan zanjirli yogʻ kislotalari sintezi uchun zarurdir. U valin, leysin va izoleysinning transaminatsiyasi natijasida hosil boʻlgan a-keto kislotalarning dekarboksillanishi uchun javobgardir va tarmoqlangan zanjirli yogʻ kislotalari sintezi uchun ishlatiladigan primerlarni ishlab chiqaradi. Ushbu fermentning faolligi toʻgʻri zanjirli substratlarga qaraganda tarmoqlangan zanjirli a-keto kislotali substratlarda ancha yuqori boʻladi va Bacillus turlarida uning oʻziga xosligi izoleysindan olingan a-keto-b-metilvaler kislotasi uchun eng yuqori, keyin esa a- ketoizokaproat va a-ketoizovalerat.[25][26] Fermentning tarmoqlangan zanjirli a-keto kislotalarga yuqori darajada yaqinligi unga tarmoqlangan zanjirli yogʻ kislotalari sintetaza uchun primer donorlik tizimi sifatida ishlashga imkon beradi.[26]
| Substrat | BCKA faoliyati | Ishlab chiqarilgan CO (nmol/min mg) | Km (mkM) | Vmax (nmol/min mg) |
|---|---|---|---|---|
| L -a-keto-b-metil-valerat | 100% | 19.7 | <1 | 17.8 |
| a-ketoizovalerat | 63% | 12.4 | <1 | 13.3 |
| a-ketoizokaproat | 38% | 7.4 | <1 | 5.6 |
| Piruvat | 25% | 4.9 | 51.1 | 15.2 |
Zanjir uzunligi va naqsh taqsimotiga ta'sir qiluvchi omillar
a-Keto kislotasi primerlari uzunligi 12 dan 17 gacha boʻlgan tarvaqaylab ketgan zanjirli yogʻ kislotalarini ishlab chiqarish uchun ishlatiladi. Ushbu tarmoqlangan zanjirli yogʻ kislotalarining nisbati maʼlum bir bakteriya turlari orasida bir xil va izchil bo'ladi, ammo malonil-KoA kontsentratsiyasi, harorat yoki issiqlikka barqaror omillar (HSF) oʻzgarishi tufayli oʻzgarishi mumkin.[25] Bu omillarning barchasi zanjir uzunligiga taʼsir qilishi mumkin va HSFlar maʼlum bir a-keto kislotasi substrati uchun BCKA dekarboksilazasining oʻziga xosligini oʻzgartirishi, shu bilan hosil boʻlgan tarmoqlangan zanjirli yogʻ kislotalari nisbatini oʻzgartirishi koʻrsatilgan.[25] Malonil-KoA kontsentratsiyasining oshishi malonil-KoA ning optimal kontsentratsiyasiga (≈20 mkM) erishilgunga qadar ishlab chiqarilgan C17 yogʻ kislotalarining katta qismiga olib kelishi koʻrsatilgan. Haroratning pasayishi, shuningdek, Bacillus turlarida yogʻ kislotalarining tarqalishini biroz C17 yogʻ kislotalari tomon siljitadi.[23][25]
Tarmoqli zanjirli yogʻ kislotalari sintazasi
[tahrir | manbasini tahrirlash]Ushbu tizim tarmoqli zanjirli yogʻ kislotalarini sintez qilish tizimiga oʻxshash ishlaydi, ammo u alfa-keto kislotalar oʻrniga primer sifatida qisqa zanjirli karboksilik kislotalardan foydalanadi. Umuman olganda, bu usul alfa-keto primerlari yordamida filial zanjirli yogʻ kislotalari tizimini bajarish qobiliyatiga ega boʻlmagan bakteriyalar tomonidan qoʻllanadi. Oddiy qisqa zanjirli primerlarga izovalerat, izobutirat va 2-metilbutirat kiradi. Umuman olganda, bu primerlar uchun zarur boʻlgan kislotalar atrof-muhitdan olinadi; Bu koʻpincha ruminal bakteriyalarda kuzatiladi.[27]
Umumiy reaksiya quyidagicha:
- Izobutiril-KoA + 6 malonil-KoA +12 NADPH + 12 H+ Shuningdeq izopalmitin kislota + 6 CO 2 12 NADP + 5 + 7 CoA[23]
(Toʻgʻri zanjirli) yogʻ kislotasi sintazasi va tarmoqli zanjirli yogʻ kislotasi sintazasi oʻrtasidagi farq asil-KoA ning atsil-ACP ga reaksiyasini katalizlovchi fermentning substrat oʻziga xosligidir.[23]
Omega-alisiklik yogʻ kislotalari
[tahrir | manbasini tahrirlash]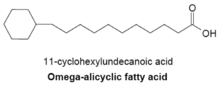
Omega-alisiklik yogʻ kislotalari odatda omega-terminal propil yoki butiril siklik guruhini oʻz ichiga oladi va bir necha turdagi bakteriyalarda topilgan asosiy membrana yogʻ kislotalari hisoblanadi. Omega-alisiklik yogʻ kislotalarini ishlab chiqarish uchun ishlatiladigan yogʻ kislotasi sintetazasi, shuningdek, membrana tarmoqli zanjirli yogʻ kislotalarini ishlab chiqarish uchun ham ishlatiladi. Asosan omega-alitsiklik yogʻ kislotalaridan tashkil topgan membranalarga ega bakteriyalarda siklik karboksilik kislota-KoA efirlarining taʼminoti tarmoqlangan zanjirli primerlarga qaraganda ancha yuqori.[23] Tsiklik primerlarning sintezi yaxshi tushunilmagan, ammo uning mexanizmi shakarlarni shikimik kislotaga aylantirishni oʻz ichiga oladi, bu esa keyinchalik omega-alisiklik yogʻ kislotalari sintezi uchun primer boʻlib xizmat qiluvchi siklogeksilkarboksilik kislota-CoA efirlariga aylanadi[27]
Tuberkulostar kislotasi sintezi
[tahrir | manbasini tahrirlash]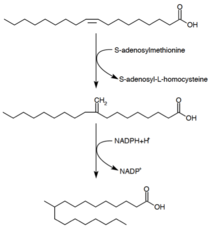
Tuberkulostear kislotasi (D -10-metilstear kislotasi) toʻyingan yogʻ kislotasi boʻlib, Mycobacterium spp tomonidan ishlab chiqariladi. va ikki turdagi Streptomyces . U oleyk kislotadan (bir toʻyinmagan yogʻli kislota) prekursordan hosil boʻladi.[28] Oleyk kislota fosfolipidga esterlangandan so'ng, S-adenosil-metionin oleyk kislotasining qoʻsh bogʻiga metil guruhini beradi.[29] Bu metillanish reaksiyasi oraliq 10-metilen-oktadekanoyal hosil qiladi. Kofaktor sifatida NADPH bilan qoldiqning ketma-ket kamayishi natijasida 10-metilstearin kislotasi[24]
Yana qarang
[tahrir | manbasini tahrirlash]- Muhim yogʻ kislotasi
- Yogʻ kislotalari almashinuvi
- Yogʻ kislotasi sintazasi
- ThYme (maʼlumotlar bazasi) (2010)
Izoh
[tahrir | manbasini tahrirlash]Manbalar
[tahrir | manbasini tahrirlash]- ↑ 1,0 1,1 Dijkstra, Albert J. „§1.4 Fatty Acid Biosynthesis“, . Trans Fatty Acids. Blackwell, 2008 — 12-bet. ISBN 9780470698075.
- ↑ „MetaCyc pathway: superpathway of fatty acids biosynthesis (E. coli)“. biocyc.org.
- ↑ 3,0 3,1 „Fatty Acids: Straight-chain Saturated, Structure, Occurrence and Biosynthesis“. lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society (2011-yil 30-aprel). 2011-yil 21-iyulda asl nusxadan arxivlangan.
- ↑ „MetaCyc pathway: stearate biosynthesis I (animals)“. biocyc.org.
- ↑ „MetaCyc pathway: very long chain fatty acid biosynthesis II“. biocyc.org.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 Stryer, Lubert. Biochemistry, Fourth, New York: W.H. Freeman and Company, 1995 — 559–565, 614–623-bet. ISBN 0-7167-2009-4.
- ↑ 7,0 7,1 7,2 7,3 Ferre, P.; Foufelle, F. (2007). „SREBP-1c Transcription Factor and Lipid Homeostasis: Clinical Perspective“. Hormone Research. 68-jild, № 2. 72–82-bet. doi:10.1159/000100426. PMID 17344645. Qaraldi: 2010-08-30. „this process is outlined graphically in page 73“
- ↑ 8,0 8,1 Voet, Donald. Fundamentals of Biochemistry, 2nd, John Wiley and Sons, Inc., 2006 — 547, 556-bet. ISBN 0-471-21495-7.
- ↑ Sloan, A.W; Koeslag, J.H.; Bredell, G.A.G. (1973). „Body composition work capacity and work efficiency of active and inactive young men“. European Journal of Applied Physiology. 32-jild. 17–24-bet. doi:10.1007/bf00422426.
- ↑ 10,0 10,1 Stryer, Lubert. Biochemistry, Fourth, New York: W.H. Freeman and Company, 1995 — 581–602, 613, 775–778-bet. ISBN 0-7167-2009-4.
- ↑ 11,0 11,1 11,2 11,3 Stryer, Lubert „Fatty acid metabolism“, . Biochemistry, Fourth, New York: W.H. Freeman and Company, 1995 — 603–628-bet. ISBN 0-7167-2009-4.
- ↑ Diwan. „Fatty Acid Synthesis“. Rensselaer Polytechnic Institute (2011-yil 30-aprel). 2011-yil 7-iyunda asl nusxadan arxivlangan.
- ↑ 13,0 13,1 Feng, Youjun; ECronan, John (2011). „Complex binding of the FabR repressor of bacterial unsaturated fatty acid biosynthesis to its cognate promoters“. Molecular Microbiology. 80-jild, № 1. 195–218-bet. doi:10.1111/j.1365-2958.2011.07564.x. PMC 4072462. PMID 21276098.
- ↑ 14,0 14,1 Zhu, Lei; et al. (2009). „Functions of the Clostridium acetobutylicium FabF and FabZ proteins in unsaturated fatty acid biosynthesis“. BMC Microbiology. 9-jild. 119-bet. doi:10.1186/1471-2180-9-119. PMC 2700279. PMID 19493359.
- ↑ Wang, Haihong; ECronan, John (2004). „Functional replacement of the FabA and FabB proteins of Escherichia coli fatty acid synthesis by Enterococcus faecalis FabZ and FabF homologues“. Journal of Biological Chemistry. 279-jild, № 33. 34489–95-bet. doi:10.1074/jbc.M403874200. PMID 15194690.
- ↑ Pfeuffer, Maria; Jaudszus, Anke (2016). „Pentadecanoic and Heptadecanoic Acids: Multifaceted Odd-Chain Fatty Acids“. Advances in Nutrition. 7-jild, № 4. 730–734-bet. doi:10.3945/an.115.011387. PMC 4942867. PMID 27422507.
- ↑ Smith, S. (1994). „The Animal Fatty Acid Synthase: One Gene, One Polypeptide, Seven Enzymes“. The FASEB Journal. 8-jild, № 15. 1248–1259-bet. doi:10.1096/fasebj.8.15.8001737. PMID 8001737.
- ↑ 18,0 18,1 „The Bacillus subtilis desaturase: a model to understand phospholipid modification and temperature sensing“. Arch Microbiol. 183-jild, № 4. May 2005. 229–35-bet. doi:10.1007/s00203-005-0759-8. PMID 15711796.
- ↑ „Mechanism of biosynthesis of unsaturated fatty acids in Pseudomonas sp. strain E-3, a psychrotrophic bacterium“. J Bacteriol. 171-jild, № 8. August 1989. 4267–71-bet. doi:10.1128/jb.171.8.4267-4271.1989. PMC 210200. PMID 2753856.
- ↑ 20,0 20,1 „DesT coordinates the expression of anaerobic and aerobic pathways for unsaturated fatty acid biosynthesis in Pseudomonas aeruginosa“. J Bacteriol. 192-jild, № 1. January 2010. 280–5-bet. doi:10.1128/JB.00404-09. PMC 2798278. PMID 19880602.
- ↑ „Both the anaerobic pathway and aerobic desaturation are involved in the synthesis of unsaturated fatty acids in Vibrio sp. strain ABE-1“. FEBS Lett. 297-jild, № 1–2. February 1992. 9–12-bet. doi:10.1016/0014-5793(92)80316-9. PMID 1551444.
- ↑ „Two aerobic pathways for the formation of unsaturated fatty acids in Pseudomonas aeruginosa“. Mol Microbiol. 60-jild, № 2. April 2006. 260–73-bet. doi:10.1111/j.1365-2958.2006.05088.x. PMID 16573679.
- ↑ 23,0 23,1 23,2 23,3 23,4 „Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance“. Microbiol Rev. 55-jild, № 2. June 1991. 288–302-bet. doi:10.1128/mr.55.2.288-302.1991. PMC 372815. PMID 1886522.
- ↑ 24,0 24,1 „Branched-chain Fatty Acids, Phytanic Acid, Tuberculostearic Acid Iso/anteiso- Fatty Acids“. lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society (2011-yil 1-may). 2010-yil 12-yanvarda asl nusxadan arxivlangan. Qaraldi: 2014-yil 8-mart.
- ↑ 25,0 25,1 25,2 25,3 25,4 25,5 „Biosynthesis of branched long-chain fatty acids by species of Bacillus: relative activity of three alpha-keto acid substrates and factors affecting chain length“. Can J Microbiol. 20-jild, № 12. December 1974. 1701–8-bet. doi:10.1139/m74-263. PMID 4155346.
- ↑ 26,0 26,1 26,2 „Biosynthesis of branched-chain fatty acids in Bacillus subtilis. A decarboxylase is essential for branched-chain fatty acid synthetase“. J Biol Chem. 263-jild, № 34. December 1988. 18386–96-bet. PMID 3142877.
- ↑ 27,0 27,1 Christie. „Fatty Acids: Natural Alicyclic Structures, Occurrence, and Biochemistry“. lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society (2011-yil 5-aprel). 2011-yil 21-iyulda asl nusxadan arxivlangan. Qaraldi: 2011-yil 2-may.>.
- ↑ Ratledge, Colin. Physiology, identification and classification, The Biology of the Mycobacteria. Academic, 1982. ISBN 9780125823012. OCLC 248050385.
- ↑ Kubica, George P.. The Mycobacteria: a Sourcebook. Dekker, 1984. ISBN 9780824719173.