Aluminiy triasetat
Alyuminiy triasetat, rasmiy ravishda alyuminiy asetat deb ataladi,[1] tarkibiga ega kimyoviy birikma. Standart sharoitda u oq, suvda eruvchan qattiq modda[2] kabi koʻrinadi, u 200 ga yaqin qizdirilganda parchalanadi. °C.[3] Triatsetat asosiy gidroksid/ atsetat tuzlari aralashmasiga gidrolizlanadi[4] va bir nechta turlar kimyoviy muvozanatda, xususan, asetat ionining suvli eritmalarida birga mavjud; alyuminiy asetat nomi odatda bu aralash tizim uchun ishlatiladi.
U qichimaga qarshi, biriktiruvchi va antiseptik xususiyatlari uchun terapevtik ilovalarga ega[5] va Burov eritmasi kabi retseptsiz dori sifatida[6] quloq infektsiyalarini davolash uchun ishlatiladi.[7][8] Burov eritmasi preparatlari aminokislotalar bilan suyultirildi va oʻzgartirildi, ularni ogʻiz boʻshligʻidagi aft yarasi kabi holatlarda gargara sifatida ishlatish yanada mazali boʻladi. Veterinariya tibbiyotida alyuminiy triasetatning biriktiruvchi xususiyati qoramol kabi tuyoqli hayvonlarda Mortellaro kasalligini davolash uchun ishlatiladi.
Alyuminiy triasetat alizarin[9] kabi boʻyoqlar bilan mordan qiluvchi vosita sifatida, ham yolgʻiz, ham birgalikda ishlatiladi. Alyuminiy diasetat[10] yoki alyuminiy sulfatsetat[11] bilan birgalikda paxta, boshqa tsellyuloza tolalari[12] va ipak bilan ishlatiladi.[11] Bundan tashqari, turli xil ranglarni ishlab chiqarish uchun temir asetat bilan birlashtirildi.[13]
Nomenklatura
[tahrir | manbasini tahrirlash]Noorganik birikmalarni nomlashning rasmiy qoidalariga koʻra, alyuminiy asetatdir, ammo alyuminiy[1] III) asetat va alyuminiy etanoat kabi rasmiy nomlar qabul qilinadi.[4] Alyuminiy triasetat nomidagi "tri" koʻpaytiruvchi prefiksdan foydalanish texnik jihatdan talab qilinmasa ham, gidroksoligandlar bilan bogʻliq birikmalar bilan chalkashmaslik uchun muntazam ravishda qoʻllanadi. Asosiy alyuminiy diatsetat, rasmiy ravishda gidroksialyuminiy diasetat (CAS RN 142-03-0),[2] tarkibga ega asetat ligand oʻrniga bitta gidrokso ligand bilan va ikki asosli alyuminiy monoasetat, rasmiy ravishda dihidroksialyuminiy asetat (CAS RN 7360-44-3) tarkibiga ega faqat bitta asetat ligand bilan keladi. Ushbu uchta birikma qattiq fazada farqlanadi, lekin odatda guruh sifatida koʻrib chiqiladi va boshqa ikkita shaklni oʻz ichiga olgan aralashmaga triatsetat gidrolizlanishi tufayli eritmadagi alyuminiy asetat sifatida birgalikda tavsiflanadi.[4] AlAc qisqartmasi, AlAc2+ kabi variantlar bilan bir qatordava, baʼzan geokimyo fanida qoʻllanadi[14], lekin ular asosiy kimyodagi standart amaliyotga mos kelmaydi. [a]
Tuzilishi
[tahrir | manbasini tahrirlash]Formula 1:3 nisbatda +3 oksidlanish darajasida alyuminiy metall markazlari va asetat guruhlari mavjudligini ko'rsatadi. Ushbu moddani tasvirlash uchun foydalanilgan tasvirlar, masalan, chapda koʻrsatilgandek, qattiq holat strukturasining ikkita haddan tashqari soddalashtirilgan taxminlarini koʻrsatadi: birinchisi, bitta alyuminiy (III) kationi (Al 3+) bilan oʻralgan sof ionli tuz kabi. elektrostatik ravishda uchta asetat anioni bilan bog'langan (, lekin bu kristal tuzilishi haqida ma'lumot etkazish uchun qabul qilinmasligi kerak. Misol uchun, natriy xlorid (NaCl) 1:1 kation-anion stexiometriyaga ega, lekin har bir ion oktaedral ravishda qarama-qarshi zaryadning olti ioni bilan o'ralgan holda kubik tuzilishga ega.[15]
Boshqa tasvir uchta asetat guruhining metall markaziga trigonal tekislik geometriyasida kovalent bogʻlangan molekulyar shakl va molekulalarni bir-biri bilan kristall tuzilishda ushlab turadigan molekulalararo oʻzaro taʼsirlardan iborat. Qattiq holat strukturasi ancha murakkab boʻlib, kovalent va ion xususiyatlarini oʻz ichiga oladi va bir nechta alyuminiy markazlari va / yoki koʻprik asetat guruhlari mavjud boʻlishi mumkin - bu ikkalasi ham alyuminiy asetat eritmasida xabar qilingan[16] va alyuminiy xlorid Al sifatida mavjudligi maʼlum dimer.[17]
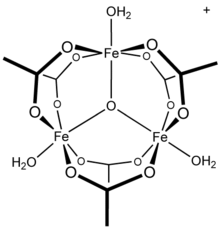
Suvli alyuminiy (III) / asetat tizimining NMR tadqiqotlari alyuminiyning hexaaqua kompleksi sifatida mavjudligini koʻrsatadi, ,[18], shuningdek, turli xil almashtirishlarga ega mononuklear turlar. Bundan tashqari, tadqiqotlar shuni koʻrsatadiki, eritma fazasining muhim turlar tridecamer,[19] gidroliz va polimerizatsiya alyuminiy eritmalarining qarama-qarshi mexanizmlarida xabar qilingan qism.[20] Boshqa uch valentli metall kationlari koʻp yadroli turlarni hosil qilishi maʼlum: masalan, temir (III) atsetat, masalan, uch koʻprikli oksomarkazga ega[21] kationi [Fe3(μ3–O)(OAc)6(H2O)3]+.[22] bilan uch yadroli tuzilmani[23] hosil qiladi. [Fe3(μ3–O)(OAc)6(H2O)3]+.[24] Murakkab xrom asetat gidroksid, Cr3(OH)2(OAc)7, shuningdek, izostrukturaviy sifatida tavsiflangan.[25] Uch yadroli tuzilishga ega boʻlgan oʻxshash ruteniy(III), vanadiy(III), rodiy(III) va iridiy(III) birikmalari maʼlum.[26] Mis (II) asetat va xrom (II) asetat ham ikki yadroli dihidrat tuzilmalariga ega, M2(OAc)4(H2O)2,[27] rodiy (II) asetat kabi;[28] har biri muhim metall-metall bog'lanish shovqinlarini ko'rsatadi.[27][28]
Kimyo
[tahrir | manbasini tahrirlash]Tayyorgarlik
[tahrir | manbasini tahrirlash]Noorganik birikmalar boʻyicha CRC qoʻllanmasiga koʻra, alyuminiy triasetat oq, suvda eriydigan qattiq moddadir va odatda alyuminiy xloriddan yoki toʻgʻridan-toʻgʻri alyuminiydan sirka kislotasi eritmasida sirka angidrid bilan isitish orqali tayyorlanadi.[2]: 3 COOH + →+ 3 HCl: 6 COOH + 2 Al → 2 + 3
Nazariy jihatdan alyuminiy / asetat / gidroksid tuzlarining barchasi alyuminiy gidroksidi yoki natriy aluminat va sirka kislotasidan tayyorlanishi mumkin, ammo triatsetat hosil boʻlishi faqat suv yoʻqligida sodir boʻladi.[4] Eritmalarda diatsetat hosil boʻlgan asosiy mahsulot boʻlib, asosiy sharoitlarda alyuminiy xlorid natriy asetat eritmasi bilan ishlov berilganda ham ishlab chiqariladi.[29] Ushbu jarayonlar uchun tenglamalar:
Alyuminiy xlorid va natriy aluminatning in situ natriy asetat bilan birikmasidan foydalangan holda takomillashtirilgan jarayon patentlangan :
Alyuminiy triasetat va alyuminiy sulfatsetat mordanlari alyuminiy sulfatdan tayyorlanishi mumkin, hosil boʻlgan mahsulot ishlatilgan qoʻrgʻoshin (II) asetat miqdori bilan belgilanadi:[11]: Al2(SO4)3 + 3 Pb(CH3CO2)2 → 2 Al(CH3CO2)3 + 3 PbSO4: Al2(SO4)3 + 2 Pb(CH3CO2)2 → Al2SO4(CH3CO2)4 + 2 PbSO4
Parchalanish
[tahrir | manbasini tahrirlash]Alyuminiy triasetat qizdirilganda 200 dan yuqori parchalanadi °C alyuminiy formatiga oʻxshash jarayonda.[3] Jarayon sirka angidridining yoʻqolishi bilan boshlanadi (Ac</br> Ac O) 120 dan 140 gacha °C[2] Al kabi asosiy oksid atsetatlar aralashmasini hosil qilish uchunAl</br> Al O(CH</br> Al CO</br> Al)</br> Al va Al</br> Al O(CH</br> Al CO</br> Al)</br> Al,[29] oxir-oqibat Al ga aylanadiAl</br> Al O</br> Al (alyuminiy oksidi), avval amorf suvsiz qattiq holatda, soʻngra boshqa qattiq fazalar (-, - va - kristal shakllari) orqali oxir-oqibat polimorf a Al ga aylanadi.- :[3]: 2 Al(CH</br> Al(CH CO</br> Al(CH)</br> Al(CH → Al</br> Al O(CH</br> Al CO</br> Al)</br> Al + CH</br> CH CO(O)COCH</br> CH → Al</br> Al O</br> Al + 3 CH</br> CH CO(O)COCH</br> CH: 2 Al(CH</br> Al(CH CO</br> Al(CH)</br> Al(CH OH → Al</br> Al O</br> Al + 2 CH</br> CH COOH + CH</br> CH CO(O)COCH</br> CH
Gidroliz
[tahrir | manbasini tahrirlash]Alyuminiy triatsetat eritmada yoki gigroskopik usulda ham mono- va di-asosli gidroksid asetatlarni hosil qilish uchun gidrolizlanadi:[4]: Al(CH3CO2)3 + H2O → Al(CH3CO2)2OH + CH3COOH: Al(CH3CO2)3 + 2 H2O → Al(CH3CO2)(OH)2 + 2 CH3COOH
Foydalanadi
[tahrir | manbasini tahrirlash]Milliy saraton instituti maʼlumotlariga koʻra, alyuminiy asetatlar odamlarda antiseptik moddalar sifatida topikal ravishda qoʻllanadi, bu ham tana toʻqimalarining qisqarishiga olib keladi.[5] Uning biriktiruvchi xususiyati qoramol kabi tuyoqli hayvonlarda Mortellaro kasalligini davolashda ham qoʻllanadi. Alyuminiy asetat infektsiyalangan terining shifo berishiga yordam beradi, shuningdek, yalligʻlanish, qichishish va qichishish bilan yordam beradi.[5] Oziq-ovqat va farmatsevtika maʼmuriyati uni " zaharli pechak ", "zaharli eman", " zaharli sumak ", "hasharot chaqishi", " sportchi oyog'i " yoki "terining kichik tirnash xususiyati tufayli vaqtincha bartaraf etish" uchun foydalanishga ruxsat berdi. sovun, yuvish vositalari, kosmetika yoki zargarlik buyumlaridan kelib chiqqan toshmalar.'"[30] Bu ilovalar uchun odatda Burov eritmasi kabi retseptsiz preparatlar qoʻllanadi[6], suyultirilgan shakllar og'iz bo'shlig'idagi aft yarasi kabi kasalliklarda, shu jumladan, aminokislota qo'shimchalari bilan birga, lazzat va ta'mni yaxshilash uchun yuvish vositasi sifatida ishlatiladi. Burov eritmasidan eng keng tarqalgan foydalanish quloq infektsiyalarini[7][8], shu jumladan otomikozni davolashda, lekin odatda bu qo'ziqorin infektsiyalarida klotrimazol kabi samarali emas.[31] Topikal biriktiruvchi kukun Domeboro tarkibida alyuminiy sulfat tetradekahidrat, [Al(H</br> [Al(H O)</br> [Al(H ]</br> [Al(H (SO</br> [Al(H)</br> [Al(H •2H</br> [Al(H O va kaltsiy asetat monohidrat, Ca(CH</br> Ca(CH CO</br> Ca(CH)</br> Ca(CH •H</br> Ca(CH O va eritilganda Burov eritmasiga o'xshash alyuminiy atsetat eritmasini hosil qiladi.[32] Domeboro eritmalari tirnash xususiyati kamaytirish va mavjud bo'lishi mumkin bo'lgan har qanday infektsiyani o'z ichiga olishi uchun oyoq tirnoqlari o'sib chiqqanda[33] ishlatilishi mumkin.
Mordant
[tahrir | manbasini tahrirlash]
Mordan - bu bo'yoq bilan muvofiqlashtiruvchi kompleks hosil qilib, mato yoki to'qima bo'laklariga bo'yoqlarni o'rnatish uchun ishlatiladigan moddadir, keyinchalik u mato yoki to'qimalarga yopishadi. Alyuminiy triasetat va alyuminiy sulfatsetat[11] yoki asosiy alyuminiy diasetat aralashmalarida bo'lgani kabi, mordan ko'pincha ko'p valentli metall ionini, odatda alyuminiy yoki temirni[35] o'z ichiga oladi.[10] Alyuminiy triasetat mordanlari paxta, boshqa tsellyuloza asosidagi tolalar[12] va ipak bilan ishlatilgan.[11] Ular, shuningdek, turli xil ranglarni ishlab chiqarish uchun temir asetat bilan birlashtirildi.[13]

Bo'yoq bo'lsa, alizarin (1,2-dihidroksi antrakinon, H</br> H Az), mordanting alizarin dianioni hosil bo'lishini o'z ichiga oladi, deb faraz qilingan. Bu besh koordinatali alyuminiy kompleksini, CaAl(OH)Az hosil qiladiCaAl(OH)Az</br> CaAl(OH)Az,[36] olti koordinatali alyuminiy markazlashtirilgan dianion Ca[Al(H) bilan gidrat hosil qilish uchun suvni qabul qila oladi.Ca[Al(H</br> Ca[Al(H O)(OH)Az</br> Ca[Al(H ]•2H</br> Ca[Al(H O.[37] Taklif infraqizil spektroskopik ma'lumotlarga asoslangan edi va keyinchalik ikki yadroli Az bog'laydigan ikkita ko'prik gidroksil ligandlari bo'lgan strukturani taklif qilish bilan e'tiroz bildirildi.Az</br> Az Al(m-OH)</br> Az AlAz 4−</br> Az, har bir alyuminiy markazga xelatlangan ikkita alizarin qismi bilan.[34] Tuzilish Soubayrol va boshqalar tomonidan taklif qilingan. 27 Al NMR spektroskopiyasi va elektrosprey ionizatsiyasi massa spektrometriyasi dalillariga asoslangan.[38] Ularning ta'kidlashicha, hidratsiya darajasi qarshi ionning identifikatoriga bog'liq bo'lib, natriy tuzi barqaror tetrahidrat bo'lib, monohidrat kaliy gidroksididan hosil bo'ladi. Ular kimyoviy siljishlariga ko'ra ajralib turardi, bu suvlarning alyuminiy markazlari yoki alizarin qismlari bilan bog'langanligini va kristallanish suvlari uchun odatiy emasligini ko'rsatadi.[38]
1994-yilda kaltsiy ionlari bilan bog'liq tuzilma haqida xabar berilgan va unda alizarinlar kaltsiy ionlariga xelatlanadi va alyuminiy markazlari (ular ham gidroksoguruhlar bilan bog'langan) o'rtasida AzCaAz ko'priklarini hosil qiladi va alyuminiy markazlari keyinchalik deprotonlangan fenol qoldiqlari bilan bog'lanadi. bo'yoq;[9] Soubayrol modelida har bir alizarin bitta alyuminiy kationi bilan bog'langan.[38] Alyuminiy asetatning tuzilishida boʻlgani kabi, ilovalarda uning shakllari hal qilinmagan.
Manbalar
[tahrir | manbasini tahrirlash]- ↑ 1,0 1,1 International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005. RSC Publishing, 2005. ISBN 0854044388.
- ↑ 2,0 2,1 2,2 2,3 Handbook of Inorganic Compounds. CRC Press, 1995 — 3-bet. ISBN 9780849386718.
- ↑ 3,0 3,1 3,2 Sato, Taichi; Ikoma, Shuji; Ozawa, Fusaji (1984). „Thermal decomposition of organic basic aluminium salts—formate and acetate“. Thermochim. Acta. 75-jild, № 1–2. 129–137-bet. doi:10.1016/0040-6031(84)85013-3.
- ↑ 4,0 4,1 4,2 4,3 4,4 „Aluminium ethanoate (aluminium acetate)“, A Dictionary of Chemistry, 6th Daintith: , Oxford University Press, 2008. ISBN 9780191726569.
- ↑ 5,0 5,1 5,2 „Aluminum Acetate (Code C47387)“. National Cancer Institute thesaurus (NCIt) (31-oktabr 2016-yil). 16-dekabr 2016-yilda asl nusxadan arxivlangan. Qaraldi: 15-noyabr 2016-yil.
- ↑ 6,0 6,1 „Acetic acid / aluminum acetate solution“. Drugs.com (3-noyabr 2016-yil). Qaraldi: 23-noyabr 2016-yil.
- ↑ 7,0 7,1 Thorp, M. A.; Kruger, J.; Oliver, S.; Nilssen, E. L. K.; Prescott, C. A. J. (1998). „The antibacterial activity of acetic acid and Burow's solution as topical otological preparations“. J. Laryng. Otol. 112-jild, № 10. 925–928-bet. doi:10.1017/S0022215100142100. PMID 10211213.
- ↑ 8,0 8,1 Kashiwamura, Masaaki; Chida, Eiji; Matsumura, Michiya; Nakamaru, Yuuji; Suda, Noriyuki; Terayama, Yoshihiko; Fukuda, Satoshi (2004). „The Efficacy of Burow's Solution as an Ear Preparation for the Treatment of Chronic Ear Infections“. Otol. Neurotol. 25-jild, № 1. 9–13-bet. doi:10.1097/00129492-200401000-00002. PMID 14724484.
- ↑ 9,0 9,1 9,2 Wunderlich, Christian-Heinrich; Bergerhoff, Günter (1994). „Konstitution und Farbe von Alizarin- und Purpurin-Farblacken“. Chem. Ber. (nemischa). 127-jild, № 7. 1185–1190-bet. doi:10.1002/cber.19941270703.
- ↑ 10,0 10,1 Haar, Sherry; Schrader, Erica; Gatewood, Barbara M. (2013). „Comparison of aluminum mordants on the colorfastness of natural dyes on cotton“ (PDF). Cloth. & Textiles Res. J. 31-jild, № 2. 97–108-bet. doi:10.1177/0887302X13480846.
- ↑ 11,0 11,1 11,2 11,3 11,4 Georgievics, Von. The Chemical Technology of Textile Fibres – Their Origin, Structure, Preparation, Washing, Bleaching, Dyeing, Printing and Dressing. Read Books, 2013. ISBN 9781447486121.
- ↑ 12,0 12,1 Brown, Donna; de Souza, Diane; Ellis, Catharine (2010). „How to Mordant Cotton—let me count the ways“. Turkey Red Journal. 15-jild, № 2. 2021-02-27da asl nusxadan arxivlandi. Qaraldi: 2022-06-06.
- ↑ 13,0 13,1 Ellis, Catharine „Transformative Processes“, . The Weaver's Studio Woven Shibori. F+W Media, Inc., 2016 — 83–84-bet. ISBN 9781632503541. [sayt ishlamaydi]
- ↑ Wesolowski, D. J. „Geochemistry of Crustal Processes to High Temperatures and Pressures“, . Summaries of FY 92 Geosciences Research. United States Department of Energy, 1992 — 38–44-bet.
- ↑ Myerson, Allan S. „Crystals, Crystal Growth, and Nucleation“, . Handbook of Industrial Crystallization, 2nd Myerson: , Butterworth-Heinemann, 2002 — 37-bet. ISBN 9780080533513.
- ↑ Alcock, Nathaniel W.; Tracy, Valerie M.; Waddington, Thomas C. (1976). „Acetates and acetato-complexes. Part 2. Spectroscopic studies“. J. Chem. Soc., Dalton Trans. 1976-jild, № 21. 2243–2246-bet. doi:10.1039/DT9760002243.
- ↑ „ALuminium chloride“, A Dictionary of Chemistry, 6th Daintith: , Oxford University Press, 2008. ISBN 9780191726569.
- ↑ Kubicki, J. D.; Sykes, D.; Apitz, S. E. (1999). „Ab Initio Calculation of Aqueous Aluminum and Aluminum−Carboxylate Complex Energetics and 27Al NMR Chemical Shifts“. J. Phys. Chem. A. 103-jild, № 7. 903–915-bet. Bibcode:1999JPCA..103..903K. doi:10.1021/jp983462w.
- ↑ Thomas, Fabien; Masion, Armand; Bottero, Jean Yves; Rouiller, James; Genevrier, Francine; Boudot, Denis (1991). „Aluminum(III) Speciation with Acetate and Oxalate. A Potentiometric and 27Al NMR Study“. Environ. Sci. Technol. 25-jild, № 9. 1553–1559-bet. doi:10.1021/es00021a004.
- ↑ Bi, Shuping; Wang, Chenyi; Cao, Qing; Zhang, Caihua (2004). „Studies on the mechanism of hydrolysis and polymerization of aluminum salts in aqueous solution: correlations between the "Core-links" model and "Cage-like" Keggin-Al13 model“. Coord. Chem. Rev. 248-jild, № 5–6. 441–455-bet. doi:10.1016/j.ccr.2003.11.001.
- ↑ Figgis, B. N.; Robertson, G. B. (1965). „Crystal-Molecular Structure and Magnetic Properties of Cr3(CH3.COO)6OCl.5H2O“. Nature. 205-jild, № 4972. 694–695-bet. Bibcode:1965Natur.205..694F. doi:10.1038/205694a0.
- ↑ Burgess, J.; Twigg, M. V.. Encyclopedia of Inorganic Chemistry, 10th, Wiley, 2005. ISBN 9780470860786.
- ↑ Weinland, R.; Dinkelacker, P. (1909). „Über Salze einer Hexaacetato(formiato)-trichrombase. II“. Ber. Dtsch. Chem. Ges. (nemischa). 42-jild, № 3. 2997–3018-bet. doi:10.1002/cber.19090420318.
- ↑ Burgess, J.; Twigg, M. V.. Encyclopedia of Inorganic Chemistry, 10th, Wiley, 2005. ISBN 9780470860786.
- ↑ „Chromium(III) Acetate Hydroxide“. chemicalbook.com. The chemical book (2016). Qaraldi: 18-noyabr 2016-yil.
- ↑ Catterick, Janet „Structures and Physical Properties of Polynuclear Carboxylates“, . Advances in Inorganic Chemistry and Radiochemistry Emeléus: . Academic Press, 1977 — 291–362-bet. ISBN 9780080578699.
- ↑ 27,0 27,1 Van Niekerk, J. N.; Schoening, F. R. L. (1953). „X-Ray Evidence for Metal-to-Metal Bonds in Cupric and Chromous Acetate“. Nature. 171-jild, № 4340. 36–37-bet. Bibcode:1953Natur.171...36V. doi:10.1038/171036a0.
- ↑ 28,0 28,1 Cotton, F. A.; Deboer, B. G.; Laprade, M. D.; Pipal, J. R.; Ucko, D. A. (1971). „The crystal and molecular structures of dichromium tetraacetate dihydrate and dirhodium tetraacetate dihydrate“ (PDF). Acta Crystallogr. B. 27-jild, № 8. 1664-bet. doi:10.1107/S0567740871004527.[sayt ishlamaydi]
- ↑ 29,0 29,1 Wade, K. „The Chemistry of Aluminium, Gallium, Indium and Thallium“, . Comprehensive Inorganic Chemistry Bailar: . Elsevier, 1973 — 1047-bet. ISBN 9781483153223.
- ↑ Food and Drug Administration „Part 347 – Skin Protectant Drug Products for Over-The-Counter Human Use“, . CFR – Code of Federal Regulations Title 21. United States Department of Health and Human Services, 1-aprel 2016-yil. Qaraldi: 15-noyabr 2016-yil.
- ↑ Munguia, Raymundo; Daniel, Sam J. (2008). „Ototopical antifungals and otomycosis: A review“. Int. J. Ped. Otorhinolaryng. 72-jild, № 4. 453–459-bet. doi:10.1016/j.ijporl.2007.12.005. PMID 18279975.
- ↑ „Domeboro – aluminum sulfate tetradecahydrate, calcium acetate monohydrate powder, for solution“. DailyMed. U.S. National Library of Medicine (12-may 2016-yil). Qaraldi: 23-noyabr 2016-yil.
- ↑ Simon, Harvey. „Ingrown Toenails“. The New York Times (31-yanvar 2013-yil). Qaraldi: 23-noyabr 2016-yil.
- ↑ 34,0 34,1 Atta-ur-Rahman „Rubia tinctorum L“, . Bioactive Natural Products (Part G), Studies in Natural Products Chemistry. Elsevier, 2002 — 629–684-bet. ISBN 9780080542065.
- ↑ Llewellyn, Bryan D.. „Stain Theory – How mordants work“ (2005-yil may). 14-avgust 2007-yilda asl nusxadan arxivlangan.
- ↑ Kiel, E. G.; Heertjes, P. M. (1965). „Metal Complexes of Alizarin V—Investigations of Alizarin–dyed Cotton Fabrics“. Coloration Technology. 81-jild, № 3. 98–102-bet. doi:10.1111/j.1478-4408.1965.tb02647.x.
- ↑ Kiel, E. G.; Heertjes, P. M. (1963). „Metal Complexes of Alizarin I—The Structure of the Calcium–Aluminium Lake of Alizarin“. Coloration Technology. 79-jild. 21–27-bet. doi:10.1111/j.1478-4408.1963.tb02507.x.
- ↑ 38,0 38,1 38,2 Soubayrol, Patrick; Dana, Gilbert; Man, Pascal P. (1996). „Aluminium-27 Solid-State NMR Study of Aluminium Coordination Complexes of Alizarin“. Magnetic Resonance in Chemistry. 34-jild, № 8. 638–645-bet. doi:10.1002/(SICI)1097-458X(199608)34:8<638::AID-OMR926>3.0.CO;2-5.








![{\displaystyle {\ce {[Al(H2O)6]^3+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e14d0be03e4329116b20ea807813ce014e280008)












